某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
(1)操作a、b的名称分别是_______、_______。
(2)写出流程中有关反应的化学方程式__________、______________。
(3)以上两个反应能够发生的原因是________。
铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是铜,最晚的是铝,原因是( )
A.三者在地壳中的含量,铜元素最高,铝元素最低
B.三者的金属活动性,铜元素最弱,铝元素最强
C.在自然界中,铜元素主要以单质形式存在,铝元素以化合物形式存在。
(2)常温下一些金属的物理性质数据如下:
| 金属单质 |
铜 |
铝 |
锌 |
铁 |
铅 |
| 导电性(以银的导电性为100作标准) |
99 |
61 |
27 |
17 |
7.9 |
| 密度/(g·cm3) |
8.92 |
2.70 |
7.14 |
7.86 |
11.3 |
| 熔点/℃ |
1083 |
660 |
419 |
1535 |
328 |
| 硬度(以金刚石的硬度为10作标准) |
2.5-3 |
2-2.9 |
2.5 |
4-5 |
1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是
(3)铝能与NaOH溶液反应,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3X, X的化学式为 。将铝丝浸入硫酸铜溶液中能形成美丽的“铜树”,发生反应的化学方程式为________
(4)工业上火法炼铜的一个主要反应是Cu2S+O2 2Cu+SO2。Cu2S中铜元素的质量分数为 。用500吨含Cu2S 80%的铜矿石,理论上可以炼出 吨铜。
2Cu+SO2。Cu2S中铜元素的质量分数为 。用500吨含Cu2S 80%的铜矿石,理论上可以炼出 吨铜。
实验室废液中含有硝酸银、硝酸铜,实验小组利用稀硫酸和铁粉分离回收银和铜,设计如下方案。
先在废液中加入过量的铁粉,充分反应后过滤得到滤渣A,其成分为银、铜和铁。再对滤渣A按如下流程图处理:
①先在废液中加入过量的铁粉,过量的目的是________。
Ⅰ、加快反应速度 Ⅱ、铁的金属活动性较强 Ⅲ、使反应充分进行
②写出CuO与H2SO4反应的化学方程式________。
③滤液D中溶质的成分有________(填化学式)。
④含有硫酸亚铁的滤液有________(填框图中字母)。
⑤如果在过滤操作中发现滤液浑浊,在仪器洁净、滤纸未破损的前提下,你认为滤液浑浊的原因可能是________。
把稀盐酸加入盛有少量铁粉和铜粉的小烧杯中,经充分反应后,加水稀释并过滤,在滤纸上剩下的物质是 ,所得滤液中生成的溶质的化学式为 。
材料的发展和应用,推动了社会的进步.铁、铜、棉花、聚乙烯塑料中人们生活和生产中常见的材料.
①上述材料中,属于天然有机高分子的是.
②铁是世界上使用最广的金属,工业上炼铁是利用一氧化碳的还原性把铁从铁的矿石中还原出来.请写出一氧化碳和氧化铁在高炉中的化学反应方程式.
③为了探究铁和铜的金属活动性强弱,完成该实验有多种方案,写出其中一种方案中涉及的化学反应方程式.
某小组同学在实验室中欲从含有硫酸亚铁、硫酸铜的废液中回收金属铜,过程如下:

(1)写出操作Ⅰ,操作Ⅱ的名称;
(2)固体 中含有;
(3)溶液 中的溶质的化学式为.
将等质量的锌粉和铁粉,分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如图所示,请回答下列问题.
(1)写出锌与稀硫酸反应的化学方程式.该反应的基本类型为反应;
(2)对于该图象的理解,下列说法正确的是(填序号).
①A表示锌和稀硫酸的反应曲线 ②反应结束后两种金属一定都有剩余
③反应结束后稀硫酸都没有剩余 ④反应结束后消耗两种金属的质量相等
⑤反应结束后所得溶液质量相等.
请回答有关金属活动性的问题:
(1)在Mg和Fe中,活动性较强的是____。
(2) Mn的活动性比Fe强,由此可知Mn与稀盐酸____填(“能”或“不能”)反应;
(3)用Fe和一种盐溶液验证Fe比Cu活泼,写出反应的化学方程式:
_______________________________________________________________
金属钴(
)与铁具有相似的化学性质。
(1)钴可形成化合价为+2和+3的两种氧化物,其化学式分别是、。
(2)已知
固体是蓝色的,
固体和
溶液都是粉红色的。将滤纸放入
溶液中浸泡,取出晾干。将干燥的粉红色滤纸用酒精灯小心烘烤,滤纸由粉红色逐渐变成蓝色,烘烤时反应的化学方程式是
(3)将金属钴投入稀硫酸中,发生化学反应 。预测可观察到的现象是。
竖炉冶铁工艺流程如图8所示。
回答下列问题:
(1)该工艺流程中,甲烷的作用是 ,冶炼出的铁水属于 (填“纯净物”或“混合物”)。
(2)用化学方程式表示还原反应室内炼铁的原理 。(写一个)
(3)该工艺流程中,可循环利用的物质是 。
冬季冰雪覆盖路面,会给交通带来很多不便。
(1)为了疏通道路常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的。
①锰钢的主要成分是Mn、C和____。
②锰钢属于 。
| A.合成材料 | B.合金 | C.金属材料 | D.化合物 |
(2)有一类融雪剂是以醋酸钾(CH3COOK)为主要成分的有机融雪剂。醋酸钾中钾元素的质量分数是 (最后结果保留一位小数)。
(3)还有一类融雪剂是以“氯盐”为主要成分的无机融雪剂,统称作“化冰盐”。常用工业碳酸钙(含有少量NaCl、FeCl3等杂质)为原料生产该融雪剂。主要生产流程如下图所示。已知:Fe(OH)3为难溶的碱。
①“操作1”的名称是 ;溶液A中加入过量熟石灰,发生反应的化学方程式是 。
②第二次加入盐酸的主要目的是 。
③固体乙的成分是 。
某校课题研究小组到电镀厂考察,了解到铁件镀铜的主要工艺流程如下: 结合流程中提供的信息回答:
结合流程中提供的信息回答:
①流程Ⅱ废水中含有的物质有_________________________________;
②经测定:流程Ⅳ中废水的pH为4,废水中一定没有________________________;
③流程Ⅳ废水中除流程Ⅰ、Ⅱ引入的物质外,还含有_______________________;
请设计简单方案来证明你的推断:
______________________________________________________________________________。
现有A、B、C三种金属,若将B放入稀盐酸中,则有氢气放出;若将C放入A的硝酸盐溶液中,则C表面有A析出;若将C放入稀硫酸中无氢气放出,据此判断:
(1)三种金属的活动性由大到小的排列顺序是______________________;
(2)若三种金属之一是汞,则汞可能是______________________。
金属是现代生活和工业生产中应用极为普遍的一类材料。
(1)图A是金属的一个应用实例,利用了金属的_______性。图B是两块金属片相互刻划后,在纯铜片上有明显的划痕。该实验探究的目的是_________________________。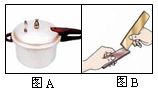
(2)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快。Al、Cu、Fe三种金属在稀盐酸里的反应现象如图所示。
①图中Y所代表的金属是 (填“Cu”或“Fe”);
②Al、Cu、Fe三种金属的活动性由强到弱的顺序为 ;
③铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是 ;
④将一片铝箔放到酒精灯火焰上加热,会发现熔化的铝并不滴落,好像有一层膜兜着。由此可知氧化铝的熔点 铝的熔点(填“>”或<”)。
(3)用一铝制易拉罐收集满一罐CO2气体,加入适量氢氧化钠溶液,封上口,振荡,会发现易拉罐先变瘪,过一段时间后又重新鼓起。
①拉罐变瘪的原因是(用化学方程式表示) 。
②易拉罐为什么又重新鼓起呢?原来铝是一种特殊的金属,能和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和一种气体单质。已知:在一个化学反应中,如果有元素化合价的升高,必然有元素化合价的降低。则铝和氢氧化钠溶液反应生成的气体单质是
(4)下图是工业炼铁的基本生产流程示意图。请回答下列问题: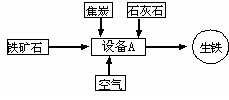
①写出设备A 的名称: ;
②写出以赤铁矿为原料在高温下制取铁的化学方程式: ;
③除了上面的炼铁方法之外,还可用铝热法炼铁,即用铝在高温下把氧化铁中铁置换出来,写出该反应的化学方程式 。
将过量的铁粉放入含硝酸银和硝酸锌的混合溶液中,使其充分反应后,过滤,滤纸上留下的物质是 。