金属随处可见,研究金属的性质可以更好地利用金属.
(1)下列金属制品中,利用金属导电性的是 (填字母序号).
(2)为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,甲车间做了如下实验:
①金属B是
②操作a的名称是 ;步骤②所涉及的化学反应方程式 ;该反应的基本反应类型是 _____反应。
(3)乙车间为回收金属,在 、
、 的混合溶液中加入一定量的锌粉,充分反应后过滤发现滤液呈蓝色,则滤液中含有阳离子是 (填离子符号)
的混合溶液中加入一定量的锌粉,充分反应后过滤发现滤液呈蓝色,则滤液中含有阳离子是 (填离子符号)
某小组同学一起探究铝、铁、铜的金属活动性顺序,小刚同学设计了用铜丝、铝丝、铁丝和稀盐酸,只用一次试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题:
(1)填表
| 实 验 步 骤 |
观察到的现象 |
| ① 在试管中取少量的稀盐酸,插入铁丝充分作用。 |
|
| ② 在①所得的溶液中,插入 ,充分作用 |
无明显现象 |
| ③ 在②所得的溶液中,插入 ,充分作用 |
|
结论:金属活动性Al>Fe>Cu
(2)插入铝丝前应进行的操作是: 。
(3)小红认为只要在上述方案中补充一个实验,就可以得出Al>Fe>H>Cu的结论,小红要补充的实验是: 。
(4)小强说,要得到Al>Fe>H>Cu的结论,不必做补充实验,只需将小刚方案中插入金属的顺序调整即可,你认为调整后插入金属的顺序是:
金属及金属材料在生产、生活中应用广泛。
(1)生活中使用的铜火锅是利用了铜的 性。
(2)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印记,此过程涉及的化学方程式是: 。
(3)有的台灯后面的反光片为铝箔,铝块能制成铝箔是利用了铝的 性。
(7分)金属材料在生活中起着重要的作用.
(1)钢铁是常用的金属材料,铁易与空气中的水和 反应而生锈.
(2)铝制品具有更好的抗腐蚀性能,是因为铝表面能生成一层 ,阻止铝进一步被氧化.
(3)金属饰品常含钯、银、铂,某兴趣小组的同学在老师的帮助下进行了相关探究.
【提出问题】依据生活经验,同学们猜测钯的活动性可能与银和铂相近
【查阅资料】钯(Pd)呈银白色,有金属光泽,可用作饰品
【实验药品】钯、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液
【实验探究】利用上述药品探究钯的金属活动性
| 实验步骤 |
实验现象 |
实验结论 |
| 把钯浸入硝酸银溶液中 |
无明显现象 |
钯的活动性比银________ |
| 把铂浸入氯化钯溶液中 |
___________ |
钯的活动性比铂强 |
得出结论:钯、银、铂的金属活动性由强到弱的顺序为 .
【废液处理】实验结束后同学们把所有液体倒入废液缸,出现白色沉淀.写出产生该现象的化学方程式:_______________.此反应属于 反应(填基本反应类型) .
人类的生产、生活离不开金属。
(1)铁是一种最主要的金属材料,实验室里用一氧化碳还原氧化铁得到铁,实验过程中,先通入一氧化碳目的是 ,该反应的化学方程式为 ;炼铁厂常以焦炭、赤铁矿、空气等为原料炼铁,焦炭可以产生反应所需的一氧化碳,还能为反应 ;
(2)炒菜时铁锅中的油着火可用锅盖盖灭,其原理是___________________________。
(3)根据下图所示回答:
加入铁粉后发生反应的化学方程式为 ,
滤渣中一定有的金属是___ ______。
“低碳生活,绿色出行”。安徽一些城市增设公共自行车。请回答下列问题:
(1)图中所标示的各部件中,属于金属材料的是 (填写序号)。
(2)公共自行车的闸线为钢丝,说明金属具有 性。
(3)车架表面喷漆不仅美观,而且可有效防止与接触而生锈。防止公共自行车链条生锈的有效措施是 。
(4)公共自行车有些零件选用了铝合金材料,其优点是质量轻、硬度大和 ,废旧自行车回收利用的意义是 。
人类生活离不开金属。
(1)铁是生活中常用的金属。某“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热。发热剂需接触到空气才会发热,原因是铁要与 、氧气等物质共同作用才会生锈。
(2)CO、C均可和金属氧化物反应,这是因为二者均有 性,木炭与氧化铜反应的化学方程式为 。
(3)应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生置换反应。
A.Cu和AgNO3溶液 B.Mg和MnSO4溶液 C.Mn和盐酸
①写出Cu和AgNO3溶液反应的化学方程式 。
②Mn、Ag、Mg、Cu四种金属的活动性由强到弱的顺序 。
化学与文学有着不解之缘,很多成语和文学作品中都蕴含着化学知识。请回答下列问题。
(1)“玉不琢不成器”发生的是_____________变化。
(2)“遥知不是雪,唯有暗香来”说明分子具有的性质是________。
(3)“钻木取火”说明燃烧需要的条件之一是 。
(4)“真金不怕火”说明金具有的性质是 。
(5)在古代人们把烧红的生铁放在铁砧上反复捶打最终使生铁转化为钢,这就是“百炼成钢”的来历,这样做的目的是降低生铁中___________元素的含量。
实验是进行科学探究的重要方式,请根据下图回答问题: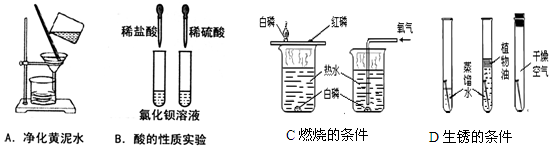
(1)用A图所示装置净化黄泥水时,玻璃棒的作用是___________________________。
(2)通过B图所示酸的性质实验,可认识到:虽然酸类物质具有相似的化学性质,但由于不同的酸溶于水时电离出的_________________不同,其性质也存在差异。
(3)实验C是通过控制哪些因素来探究可燃物燃烧的条件? 。
(4)请总结出铁制品发生锈蚀的主要条件? 。
某市境内河流发生了镉浓度超标事件。根据该事件某化学活动小组开展了一次关于金属镉与铜、银活动性顺序的探究及镉污染事故处理方法的研讨活动。
查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价
②水体中镉元素通常以氯化镉的形式存在
③氯化镉能溶于水,氢氧化镉难溶于水
(1)金属镉与铜、银活动性顺序的探究
| 实验步骤 |
实验现象 |
实验结论 |
| 取适量镉、铜、银于试管中,加入足量 |
镉表面有气泡产生,铜、银表面无气泡产生 |
镉的活动性顺序大于铜与银 |
| 取适量铜于试管中,加入少量硝酸银溶液 |
, 。 |
铜的活动性顺序大于银 |
实验结论:活动性顺序:镉>铜>银
上述两个实验步骤中所发生的反应的共同点是 (填一项即可)
(2)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为 ;小敏认为该方案虽然有效,但有缺陷,原因是 。受小聪与小敏启发,你认为可以用 (写俗称)代替烧碱。
绝大多数金属都能与Cl2直接化合生成金属氯化物,如2Na+ Cl2=2NaCl、Cu+ Cl2  CuCl2等。已知A、B、C、D、E五种物质有如下图转化关系(个别反应条件已略去)。已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A 、C都能与Cl2直接化合生成相应的金属氯化物B、E。回答下列问题:
CuCl2等。已知A、B、C、D、E五种物质有如下图转化关系(个别反应条件已略去)。已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A 、C都能与Cl2直接化合生成相应的金属氯化物B、E。回答下列问题:
(1)A为 、B为 。
(2)D与Cl2化合生成E的化学方程式为 。
(3)A与E也可以化合生成D,请写出化学反应方程式 。
人类的生产、生活离不开金属。
(1)目前世界上年产量最高的金属是 (填化学式) ;
(2)铁制品锈蚀,实际上是铁跟空气中的 发生了化学反应。防止铁制栏杆锈蚀的一种方法是 ;
(3)已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4溶液
B.Mg和MnSO4溶液
C.Mn和FeSO4溶液
①写出Fe 和CuSO4溶液反应的化学方程式 ;
②Mn、Fe、Mg、Cu四种金属的活动性由强到弱的顺序 。
(4)工业生产中常用10%的稀盐酸来除去铁制品表面的铁锈,实验室若要配制该盐酸200g,则需要溶质的质量分数为38%的浓盐酸 g(计算结果请保留至0.1g);实验室在配制10%的稀盐酸的过程中,除了用到烧杯、量筒和胶头滴管外,还需要用到的玻璃仪器是 。
(5)某化学小组在实验结束后,进行了如下废液处理:
①Ⅰ中的操作名称是 ;
②写出Ⅱ中一定发生反应的化学方程式 ;
③滤液中溶质的组成可能是 (写出一种情况即可)。
(1)归纳与比较,是学习化学的重要方法之一,对比CO和CO2,它们的组成元素 (填“相同”或“不同”,下同),但它们的化学性质 ;工业上CO可用来炼铁,请写出反应的化学方程式 ,废气不能随意排放,处理方法是 。
(2)铝具有良好的抗腐蚀性,请用化学方程式解释原因 。
(3)洗涤剂去油污的原理是:洗涤剂 ;汽油去油污的原理是 。
金属材料和我们生活息息相关。
(1)生铁和钢都是铁合金,性能优良,硬度均比纯铁 ________(填“大”或“小”),其中生铁中含碳量为________。生铁和钢在潮湿的空气中均易锈蚀,本质是铁和空气中_________和_____________反应;
(2)家用铝壶表面常有灰色斑点,这是因为____________________________(用化学方程式表示),铝壶内的水垢[含CaCO3]可用厨房中适量的________________(填名称)去除;
(3)现代湿法冶金的先驱是指 ________________________(用化学方程式表示),属于__________________反应(基本反应类型)