我国建设高铁在促进“一带一路”建设中发挥独特的作用。试回答:
(1)铺设火车道轨,一般用的合金钢是___________钢材;
(2)连接导线的电刷多采用石墨板,是利用其三个优点是______________________;
(3)高铁车体采用大量的铝合金,其应用的重要目的是(答三点)_______________________________,运行时,其能量转化是______________________;
(4)乘坐高铁在不超重的前提下,下列哪些物品不能带上列车_____________(填序号)
①面粉 ②硝酸钾化肥 ③浓硫酸 ④酒精 ⑤红磷。
将5.6 g含有一种杂质的铁粉与足量的稀盐酸反应,生成0.21 g氢气,则该铁粉中混入杂质是___________(填“铜”或“铝” )。把这种铁粉放入硝酸银溶液中,充分反应后过滤。将滤渣洗净,滴入稀硫酸,如果无气泡产生,则滤液中一定含有的溶质是__________(填化学式);如果有气泡产生,则滤渣的成分中一定含有_____________________(填化学式)。
现有甲、乙、丙三种金属,将甲、乙两种金属分别放入硫酸铜溶液中,甲表面有红色固体析出,乙没有明显现象;将甲、丙分别与相同的稀硫酸反应,甲比丙反应慢。下列金属活动性顺序的排列正确的是
| A.甲>乙>丙 | B.丙>乙>甲 | C.乙>甲>丙 | D.丙>甲>乙 |
水龙头中常镀铬。铬是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬( CrSO4)溶液,请回答:
(1)铬的元素符号_________
(2)写出铬与稀硫酸反应的化学方程式
(3)预测铬与稀硫酸反应的现象:
(4)结合现象分析,该反应过程中,溶液中逐渐减少的离子是 ,(写离子符号,下同)
逐渐增多的离子是 。
某钢铁厂高炉炼铁的主要原料是焦炭、赤铁矿石(主要含Fe2O3)、空气等,主要反应过程如下:
请回答:
(1)步骤1所涉及的化学反应方程式为__ ______ _。
(2)步骤2的化学方程式 。
(3)某钢铁厂每天需消耗5000t含Fe2O3 80%的赤铁矿,该厂理论上可日产含铁98%的生铁的质量是_________t(结果保留整数)。
(4)向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,得到滤渣和滤液。向滤渣中滴加稀盐酸,无气泡产生,则滤渣中一定不含有_______(填化学式),滤液中一定含有的溶质是______(填化学式)。
已知镉(Cd)的金属活动性与锌相近,镉元素在化合物中常显+2价。
(1)锌与氧气加热时的化学方程式是 。
(2)镉的主要矿物是硫镉矿(硫化镉),硫化镉的化学式为 。
(3)含硫酸镉的废水,可用氢氧化钠溶液生成沉淀处理,化学方程式是 。
(4)将含氧化镉的细颗粒和炭粉混合后,隔绝空气加热至1200℃,可得镉蒸气和一氧化碳。
反应的化学方程式是 。
为了探究影响铁与盐酸反应剧烈程度的因素,某学习小组设计了下列实验:
下列说法正确的是
| A.对比实验①和②,可研究盐酸的浓度对反应剧烈程度的影响 |
| B.对比实验②和③,可研究盐酸的浓度对反应剧烈程度的影响 |
| C.对比实验②和③,可研究温度对反应剧烈程度的影响 |
| D.对比实验①和②,可研究温度对反应剧烈程度的影响 |
一种工业废水中含有大量的硫酸亚铁、少量硫酸铜和污泥(污泥不溶于水,且不参与化学反应)。某同学设计了一个既经济又合理的实验方案,制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜。方案流程如下:
【查阅资料】FeSO4·7H2O受热易分解。
回答下列问题:
(1)加入过量试剂a的目的是 。
(2)操作③中产生气体的化学方程式是 。
(3)下列说法正确的是 。
| A.溶液1中的溶质质量一定大于溶液2中的溶质质量 |
| B.溶液3中的质量分数大于或等于溶液2 |
| C.操作④中可以用蒸发溶剂结晶的方法 |
| D.操作③中所加物质一定要适量 |
(1)地壳中含量最多的金属元素是 。
(2)生活中的钢铁制品通常是铁的合金,合金属于 (填“混合物”或“纯净物”)。
(3)一般的导线由铜丝组成,说明铜有其良好的 性(填一条)。
(4)早在西汉时期,人们主要采用“湿法冶金”。如将铁浸入硫酸铜溶液中,该反应的化学方程式为 ,基本反应类型为 。
含锌30%的黄铜用作弹壳的制造。现有一批使用过的、锈迹斑斑的弹壳,处理这些弹壳可以制得铜和硫酸锌,其主要过程如下图所示。
提示:弹壳上的锈主要为Cu2(OH) 2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水、不参加反应。
(1)固体D为 。
(2)溶液A中加入E后发生反应的化学方程式为 。
金属在生产、生活中应用广泛。
(1)在汽车电路中,经常用铜作导线,这是利用了铜的延展性和 。
(2)铝抗腐蚀性能好,是因为铝与氧气反应,在其表面生成一层致密的氧化铝薄膜,氧化铝的化学式为 。
(3)黄铜是铜锌合金,将纯铜片和黄铜片相互刻画(如图所示),纯铜片上留下明显的划痕,说明 。
化学小组探究镁、铁、铜三种金属的活动性顺序,设计了下图所示实验方案。
(1)试管乙中观察到的现象是 ,反应的化学方程式为 。
(2)同学们经讨论后认为该方案可以优化, 试管的实验是多余的。
(3)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,有气泡产生,则滤渣的成分可能是 。
工业废水中含有硫酸亚铁、硫酸铜和污泥。某同学设计了利用废水制备硫酸亚铁晶体(FeSO4·7H2O)并回收铜的实验方案,流程如下:
已知:硫酸亚铁晶体受热易分解。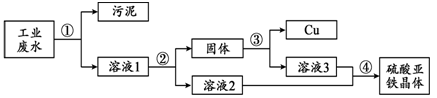
回答下列问题:
(1)步骤②中需加入的物质及目的是 。
(2)步骤③中发生反应的化学方程式为 。
(3)步骤④的操作是蒸发浓缩、降温结晶、 。
阅读下面科普短文。
19世纪初,铝是比黄金还贵的金属,主要是由于铝的化学性质很活泼,在自然界以化合物形式存在。当时采用钠与氯化铝在一定条件下发生置换反应得到铝,因生产成本高,所以铝十分珍贵。
19世纪末,霍尔应用电解熔融金属化合物的方法制备金属。他在用氧化铝制备金属铝的过程中,发现氧化铝的熔点很高(2050℃),很难达到熔融状态,必须物色一种能够溶解氧化铝而又能降低其熔点的材料,实验过程中发现冰晶石(Na3AlF6)能起到这种作用。
霍尔在坩埚中,把氧化铝溶解在10%~15%的熔融的冰晶石里进行电解,发现有小球状银白色的铝生成,冰晶石在电解过程中不被分解,并有足够的流动性,有利于电解的进行。这种廉价炼铝方法的发现,使铝成为广泛应用的金属材料,至今仍在使用。
根据文章内容,回答下列问题:
(1)金属铝的物理性质 。
(2)冰晶石中氟元素的化合价为 。
(3)用金属钠制取铝的化学方程式为 。
(4)霍尔用电解法制取铝的化学方程式为 。
(5)电解法制铝的过程中,冰晶石的作用是 。