如图,表示镁、铜与其氧化物的质量关系。图线不重合的原因是 ( )

| A. | 镁和铜的密度不同 |
| B. | 与等质量的镁和铜化合的氧元素质量不同 |
| C. | 加热不充分,没有完全氧化 |
| D. | 实验的误差造成 |
实验室用50g溶质质量分数为19.6%的稀硫酸与足量的锌粒充分反应,可以生成氢气多少克?
请回答下列与金属有关的问题:
(1)生铁片与纯铁片相互刻画时,纯铁片表面可留下划痕,说明的硬度大;
(2)
与足量的稀硫酸反应(化学方程式为
),理论上可制得氢气的质量为
;
(3)使用下列各组试剂,能验证 活动性顺序的是.
| A. |
溶液 溶液 |
B. |
溶液 |
C. |
溶液 |
用 溶液测定某种氮肥中 的质量分数(杂质溶于水,但不参加反应).
实验如下:称取该氮肥20
加水完全溶解,向该溶液中不断滴入
溶液,生成气体及沉淀质量与加入
溶液的质量关系如下所示:

| 实验次序 |
1 |
2 |
3 |
| 滴入 溶液的质量 | 20 |
40 |
60 |
| 生成气体的质量 | 0.85 |
2.55 |
试分析并计算:【已知:
】
(1)表格中
的值为
.
(2)实验所用氢氧化钡溶液中溶质的质量分数.
(3)该氮肥中 的质量分数.(计算结果精确至0.1 )
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品12.0g,向其中加入57.9g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:
(1)小明要从反应后的溶液中提取NaCl应采用的方法是 ;
(2)纯碱样品中的Na2CO3的质量分数是多少?(结果保留一位小数,要求写出计算过程)
(3)反应后所得溶液中NaCl的质量分数是多少?(要求写出计算过程)
2010年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水反应):
| |
烧杯① |
烧杯② |
烧杯③ |
烧杯④ |
烧杯⑤ |
| 加入样品的质量/g |
10 |
10 |
10 |
10 |
10 |
| 加入稀盐酸的质量/g |
10 |
20 |
30 |
40 |
50 |
| 充分反应后生成气体的质量/g |
0.88 |
1.76 |
X |
3.52 |
3.52 |
(1)表中X的值为 ;
(2)碳酸钙恰好完全反应时消耗稀盐酸 g;
(3)求样品中碳酸钙的质量分数为多少?
某同学做了如下图所示的实验,在14.6%的稀盐酸中加入碳酸钙,后加入10.6%的碳酸钠溶液
| |
第一次 |
第二次 |
| 14.6%的稀盐酸的质量 |
m |
m |
| 加入碳酸钙的质量 |
10g |
20g |
| 加入10.6%的碳酸钠溶液的质量 |
100g |
200g |
| 加入碳酸钠溶液后,实验现象 |
只有气泡 |
只有白色沉淀 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题
写出实验一中发生化学反应的方程式
第一次实验中加入碳酸钙后溶液中溶质成分
根据已知条件列出求解第二次实验生成沉淀的质量的比例式
实验中加入稀盐酸m的质量为
若将第二次反应后的溶液蒸发191.2g水,则所得不饱和溶液中溶质的质量分数为
若用溶质质量分数29.2%的浓盐酸配置实验所需的稀盐酸,则需要加水的质量
实验室需用氯酸钾制取氧气,化学方程式: 2 KClO3 KCl + 3O2↑。现将 29.4g 氯酸钾与 5.6g 二氧化锰的混合物加热一段时间后,冷却,称量剩余固体的质量为 25.4g。回答:
KCl + 3O2↑。现将 29.4g 氯酸钾与 5.6g 二氧化锰的混合物加热一段时间后,冷却,称量剩余固体的质量为 25.4g。回答:
(1)生成氧气的质量是多少?
(2)剩余固体中氯化钾质量是多少?
(3)固体剩余物中是否还含有氯酸钾?
某锌样品15g加入50g稀硫酸中(杂质既不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为64.6g。试计算:
(1)生成氢气的体积。(精确到0.1L,在标准状况下氢气的密度为0.9g/L)
(2)锌粒中所含锌的质量分数(精确到0.1%)。
某同学称取a g铜锌合金,加入足量稀硫酸,充分反应后测得生成气体的质量为b g,剩余固体经过滤、洗涤、干燥后,称得质量为c g.请问:
(1)a g铜锌合金中锌的质量为 g(用代数式表示).
(2)根据化学反应方程式,推导出a、b、c三者之间的等量关系(写出详细的计算推导过程).
某同学做了如下实验:
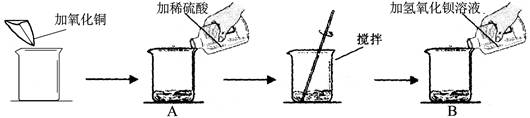
实验数据及部分实验现象如下表:
| |
第一次 |
第二次 |
| 加氧化铜的质量(g) |
m |
m |
| 加稀硫酸的质量(g) |
50 |
100 |
| 加氢氧化钡溶液的质量(g) |
100 |
100 |
| B中主要现象 |
淡蓝色沉淀 |
? |
若第一次试验每一步均恰好完全反应且所用氢氧化钡溶液的溶质的质量分数为8.55%,请回答下列问题:
1、写出第一次试验有溶液颜色改变的化学反应方程式 ;
2、第二次实验B中的主要现象是 ;
3、试验中加入氧化铜m的数值为 ;
4、求解第二次反应中生成固体质量(X)的比例式 ;
5、若将第二次反应后的滤液蒸发32.35克水,则所得不饱和溶液中溶质的质量分数为 ;
6、若用98%的浓硫酸配制试验中所需硫酸,则需要加水的质量为 。
某混合物中含有碳酸钙和氯化钙,取该混合物6g,向其中加入一定质量的质量分数为10%的稀盐酸,恰好完全反应,产生2.2g气体。(假设气体全部逸出)。
计算:
(1)所取混合物中碳酸钙的质量。
(2)所加稀盐酸的质量
(3)反应后所得溶液中溶质的质量分数(计算结果精确到0.1%)
实验室欲测定一瓶标签破损的稀H2SO4的溶质质量分数。现取10g稀硫酸样品,将5%的NaOH溶液逐滴加到样品中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。试回答: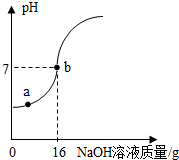
(1)a点溶液中含有的离子有 。
(2)计算稀H2SO4的溶质质量分数。
某化学探究小组的同学为测定某样品中铁的质量分数,他们将样品放入烧杯中,再加入足量的稀盐酸,至不再有气泡产生为止.各步称量数据如下:(稀盐酸的挥发可忽略不计)
生铁样品质量为11.5 g ; 烧杯的质量 为32.5 g ; 所加稀盐酸的质量为200.0 g;
反应后烧杯及所盛物质的总质量为243.6 g 请回答下列问题:
(1)反应中产生气体的质量是 g.
(2)计算该生铁样品中铁的质量分数(写出计算步骤,计算结果精确到0.1%).