碳酸钙在高温条件下发生如下反应:CaCO3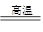 CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
| A.28.0 g | B.44.8 g |
| C.56.0 g | D.78.0 g |
有氮气、一氧化碳和二氧化碳的混合气体40 g,其中碳元素的质量分数为30%.使该混合气体通过足量的灼热氧化铁充分反应后。再将气体通入过量的石灰水中,能得到白色沉淀的质量为
| A.30 g | B.50 g | C.l00 g | D.150 g |
葡萄糖溶液是将葡萄糖(化学式为:C6H12O6)溶于水形成的。某温度下一定质量的葡萄糖溶液中氢元素的质量分数为10%,则该溶液中碳元素的质量分数为( )
A.5%B.10%C.25%D.60%
现有部分被氧化的铜粉固体混合物,为研究铜粉的组成情况,取4g混合物,先加热完全氧化后,再加入60g9.8%的稀硫酸恰好完全反应,则固体混合物中铜单质的质量分数为( )
| A. |
80% |
B. |
64% |
C. |
16% |
D. |
96% |
现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中()
| A. | 碳酸钠消耗的氯化氢多 | B. | 碳酸氢钠生成的二氧化碳多 |
| C. | 碳酸氢钠消耗的氯化氢多 | D. | 碳酸氢钠生成的二氧化碳多 |
有一镁和氧化镁的混合物,测得其中镁元素的质量分数为80%。现取该混合物6.0克,加入足量的稀硫酸完全反应后,生成硫酸镁的质量为
| A.12.0g | B.24.0g | C.20.0g | D.40.0g |
肾病患者需要食用低钠盐的食品。目前,市场供应的低钠盐多为苹果酸钠盐(C4H5O5Na)。每日食用5g苹果酸钠盐,人体摄入的钠元素质量仅为等量食盐中钠元素质量的
| A.18.7% | B.26.7% | C.37.5% | D.43.1% |
把6.4g铁粉投入到硫酸和硫酸铜的混合溶液中,反应中有气体产生,铁粉恰好完全反应。过滤得到的固体物质的质量与原来加入的铁粉质量相等。则产生氢气的质量为
| A.1/32 g | B.1/35 g | C.1/64 g | D.1/70 g |
利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2)。每次取100g样品配制成溶液,向其中加入10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:
| 测定次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 样品质量(g) |
100 |
100 |
100 |
100 |
| 氢氧化钠溶液质量(g) |
40 |
80 |
120 |
160 |
| 沉淀质量(g) |
2.9 |
5.8 |
8.7 |
8.7 |
(1)第 次加入的氢氧化钠溶液与粗盐中的MgCl2恰好完全反应。
(2)求粗盐的纯度(写出解题过程)。
锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体硫酸锌、硫酸铝、硫酸镁混合物11g,则反应中生成氢气的质量为
| A.0.15g | B.0.20g | C.0.30g | D.0.45g |
根据右图所提供的信息,下列对该袋食盐的判断不正确的是
| A.该食盐中氯元素的质量分数最大 |
| B.每袋食盐中碘元素的质量为10 mg |
| C.每袋食盐中含碘酸钾的质量约为16.9 mg |
| D.若仅靠该盐补充碘,成人每天需摄入该食盐5 g |
将一定质量的铁和氧化铜的混合物粉末放入足量稀盐酸中,充分反应后产生气体0.4g,并得到残留固体6.4g。则原混合物粉末的质量是()
| A. | 8.0g | B. | 11.2g | C. | 16.0g | D. | 19.2g |
在一硬质玻璃管中盛放着3g CuO和Cu的混合物,通入O2加热至不再反应,冷却后,将玻璃管内固体物质投入到适量稀硫酸中,恰好完全反应,得到50g溶质质量分数为12%的蓝色溶液,则原混合物质中铜元素和氧元素的质量比是
| A.2:1 | B.4:1 | C.8:1 | D.12:1 |
在化学反应A2+BC=B+A2C中,反应物BC与生成物 B的质量关系如图所示。将2g A2与80g BC恰好完全反应,则生成A2C的质量是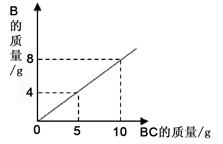
| A.64g |
| B.18g |
| C.80g |
| D.9g |
实验室测定菱铁矿主要成分的含量时,取29g含杂质的菱铁矿(杂质不溶于水也不与酸反应)加入到200g稀盐酸中,恰好完全反应,过滤得滤液214.4 g,则该菱铁矿主要成分的质量分数为
| A.75% | B.80% | C.85% | D.90% |