某同学进行硫酸铜晶体(化学式为CuSO 4•5H 2O)的制备和生长实验,配制了某温度时的硫酸铜热饱和溶液,静置、冷却到室温,观察晶体的生长,如图。
(1)能判断原硫酸铜溶液已饱和的方法是 。
A.观察颜色,溶液蓝色较深
B.溶液冷却,有蓝色晶体析出
C.蒸发少量水,有蓝色晶体析出
D.加入硫酸铜晶体,晶体质量不变
(2)现称取49克无水硫酸铜溶于水,配成150克某温度时的热饱和溶液,再冷却到室温,共析出50克硫酸铜晶体,请计算该室温时硫酸铜饱和溶液的溶质质量分数。

溶液与人们的生产生活密切相关。
(1)下列常见物质不属于溶液的是 (填序号)。
A.生理盐水
B.糖水
C.医用酒精
D.牛奶
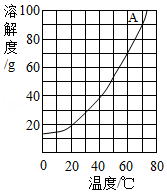
(2)如图是A物质的溶解度曲线,下表是B物质在不同温度时的溶解度。
|
温度/℃ |
B物质溶解度/g |
|
0 |
32 |
|
20 |
35 |
|
40 |
40 |
|
60 |
45 |
|
80 |
55 |
①60℃时,A物质的溶解度是 g。
②50℃时,向100g水中加入40g B物质,充分溶解后得到的是 (填"饱和"或"不饱和")溶液,此时溶液的溶质质量分数是 (结果保留两位小数)。
③请根据表格数据,在A物质溶解度曲线图上绘出B物质的溶解度曲线。
④A、B两种物质溶解度相同时的温度是 ℃。
(3)生活中常用75%酒精消毒液对手和皮肤进行消毒。请分析酒精浓度与杀死细菌的时间对比表(如下)中的数据,酒精消毒液的最合适浓度应为 。根据酒精的物理性质,你认为两者浓度差异的主要原因是 。
|
酒精浓度(%) |
大肠杆菌 |
金黄色葡萄球菌 |
溶血性链球菌 |
|
90 |
15小时 |
30分钟 |
5分钟 |
|
80 |
1小时 |
30分钟 |
5分钟 |
|
70 |
30秒 |
5分钟 |
10秒 |
|
60 |
20秒 |
30分钟 |
10秒 |
|
50 |
20秒 |
2小时 |
20秒 |
|
40 |
22分钟 |
4小时 |
2分钟 |
常温下,向盛有100.0g KOH溶液的烧杯中逐滴加入120.0g质量分数为7.3%的稀盐酸,用pH计(精确测定溶液pH的仪器)测定反应过程中溶液的pH,所得数据如表:
|
加入稀盐酸的质量/g |
60.0 |
80.0 |
100.0 |
120.0 |
|
烧杯中溶液的pH |
13.7 |
13.3 |
7.0 |
0.7 |
(1)恰好完全反应时,消耗稀盐酸的质量为 g。
(2)求该KOH溶液中溶质的质量分数(结果精确到0.1%)。
下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
溶解度/克 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |

(1)10℃时,100克水中最多可溶解硝酸钾的质量为 克。
(2)20℃时,将10克硝酸钾加入40克水中,所得溶液溶质质量分数为 。
(3)如图是硝酸钾溶液的变化情况,请写出一种可采用的操作方法。(写出计算过程)
复方碳酸氢钠片是一种常用的抗酸剂药物,口服后能迅速中和或缓冲胃酸,减少疼痛等症状。复方碳酸氢钠片的主要成分是碳酸氢钠(与盐酸反应的化学方程式为:NaHCO3+HCl═NaCl+H2O+CO2↑)。
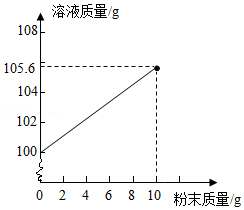
某科学兴趣小组为了测定药片中碳酸氢钠的含量做了以下实验:先将复方碳酸氢钠片制成粉末,取10克分多次放入盛有100克稀盐酸的烧杯中充分反应。测出加入的粉末质量和反应后的溶液质量,两者质量关系如图所示。
(1)实验后,兴趣小组又往烧杯中加入少量粉末,观察到 ,说明上述实验结束时稀盐酸过量。
(2)计算复方碳酸氢钠片中碳酸氢钠的含量。
(3)计算10克粉末与稀盐酸反应后所得氯化钠溶液的溶质质量分数。(计算结果精确到0.1%)
往80g含有硝酸铜和硝酸银的混合溶液中加入一定量的镁粉,加入的镁粉的质量与溶液质量变化如图所示。试分析计算:
(1)a→b段表示镁粉与混合溶液中的 反应。(填化学式)
(2)原混合溶液中硝酸铜的质量分数是多少?(写出计算过程,精确到0.1%)

如图2为某钙片的商品标签,为测定钙片中钙元素的质量分数(假设钙片中其他物质不含钙元素,且不溶于水,也不与任何物质发生反应),某化学兴趣小组取20片钙片,进行如下实验:

(1)上述实验过程中发生反应的化学方程式为 。
(2)根据已知条件列出求解所加的稀盐酸中溶质质量(x)的比例式 。
(3)用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为 。
(4)钙片中钙元素的质量分数为 。
(5)若向滤液中加入5.4g水,所得溶液中溶质的质量分数为 。
(6)工厂生产钙片时若需碳酸钙120t,理论上需含氧化钙84%的生石灰的质量为 。
为测定某工厂排放的废水中氢氧化钠的含量,化学兴趣小组将100g该废水与50g硫酸铜溶液混合恰好完全反应,得到4.9g沉淀。请计算这一废水中氢氧化钠的质量分数。
实验室常用高锰酸钾(KMnO4)制取氧气,生活中常用0.1%的高锰酸钾溶液来消毒。
(1)高锰酸钾中钾、锰、氧三种元素的质量比为 。
(2)若要配制50g质量分数为0.1%的高锰酸钾溶液,需要质量分数为1%的高锰酸钾溶液 g。
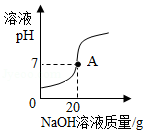
实验室中稀硫酸因标签破损,需测定其质量分数。某化学兴趣小组的同学取该稀硫酸样品50g,逐滴加入质量分数为16%的NaOH溶液,溶液的pH随加入NaOH溶液质量的变化如图所示。
(1)图中A点时溶液中溶质的化学式是 。
(2)求稀硫酸中溶质的质量分数(写出计算过程,计算结果精确到0.01%)。
中华文化源远流长,早在西汉时期《淮南万毕术》一书中就有“曾青得铁则化为铜”的记载,这是我国现代“湿法炼铜”的先驱。某大型工厂利用此原理处理含硫酸铜的废液回收金属铜时,向100kg的废液中加入足量的铁粉,得到金属铜6.4kg。
(1)计算废液中硫酸铜的质量分数是多少?
(2)金属资源保护的有效途径之一是金属的回收再利用,其它有效途径还有 (写一条)。
为测定某盐酸的溶质质量分数,同学们进行了如下实验:将该盐酸逐滴加入到盛有20g 4%的氢氧化钠溶液的烧杯中,用玻璃棒不断搅拌,并测定溶液的pH.当pH=7时,共用去该盐酸14.6g.
(1)实验过程中,搅拌的目的是 .
(2)计算该盐酸的溶质质量分数.
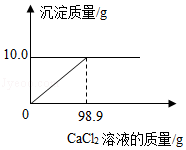
称取NaCl和Na2CO3的固体混合物11.1g,加入100.0g水配成溶液后,向其中逐渐加入一定浓度的CaCl2溶液。所加CaCl2溶液的质量与生成沉淀的质量关系如图所示。(提示:Na2CO3+CaCl2═CaCO3↓+2NaCl)
(1)恰好完全反应时生成CaCO3的质量是 g。
(2)当恰好完全反应时,计算所得溶液中溶质的质量分数。(写出计算过程)
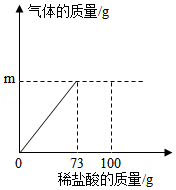
实验室用12.5g含碳酸钙80%的石灰石和一定质量的稀盐酸反应制取二氧化碳(石灰石中的杂质不溶于水,也不与稀盐酸反应),加入稀盐酸的质量与产生气体的质量关系如图所示,试计算该稀盐酸中溶质的质量分数。