某学习小组对碳酸钠、碳酸氢钠和稀盐酸的反应进行了探究。
(1)分别在盛有少量碳酸钠(俗称 )、碳酸氢钠固体的试管中加入足量稀盐酸,观察到都剧烈反应且产生大量气泡。碳酸氢钠和稀盐酸反应的化学方程式为 。
[提出问题]
碳酸钠、碳酸氢钠和稀盐酸反应产生二氧化碳的快慢是否相同?
[设计与实验]
(2)甲设计的实验如图1所示,实验时,两注射器中的稀盐酸应 (填操作),观察到图2所示现象。于是他得出碳酸氢钠和稀盐酸反应产生二氧化碳较快的结论。
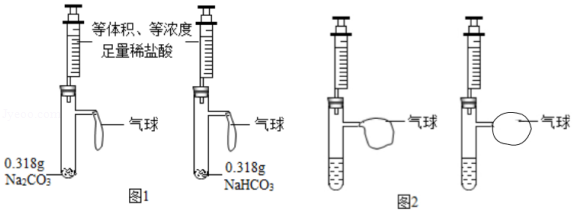
(3)乙对甲的实验提出了质疑:
①碳酸钠、碳酸氢钠固体和稀盐酸反应都很剧烈,通过观察很难判断产生气体的快慢;
② ,他认为,应取含碳元素质量相同的碳酸钠和碳酸氢钠,若碳酸钠的质量仍为0.318g,应称取 g碳酸氢钠。
(1)小组同学在老师指导下设计了图3所示的实验。
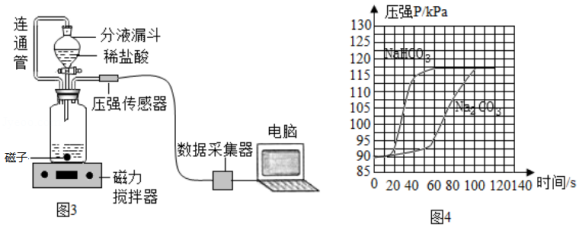
①连通管的作用是 。
②分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液(各滴2滴酚酞溶液),以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,溶液颜色变化记录如表1.广口瓶内压强随时间变化如图4所示。
表1:
|
滴入酚酞溶液 |
滴入稀盐酸,溶液颜色变化 |
|
碳酸钠溶液 |
红色 |
红色→浅红色→无色 |
|
碳酸氢钠溶液 |
浅红色 |
淺红色→无色 |
[实验结论]
(5)分析图4所示的实验数据可得到的结论是:相同条件下, 和稀盐酸反应产生二氧化碳较快,理由是 。
[反思与应用](6)小组同学分析表1实验现象和图:4数据,得出另一种物质和稀盐酸反应产生二氧化碳较慢的原因是 (请用必要的文字和化学方程式说明)。
(7)通过以上探究与分析,小组同学设计了只用试管和胶头滴管鉴別碳酸钠溶液和稀盐酸的实验。
|
操作 |
现象与结论 |
|
未知溶液分別编号为a、b,取适量a于试管中,用胶头滴管逐滴滴入b并振荡 |
|