A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答问题。

(1)t1℃时,三种固体物质的溶解度的大小关系是 。
(2)若B中含有少量的A时,提纯B的方法是 。
(3)t2℃时,将80gA物质放入100g水中,所得溶液中溶质与溶剂的质量比是 (填最简整数比)。
(4)将t2℃时等质量的A、B、C三种物质的饱和溶液,降温到t1℃时所得溶液质量由大到小的顺序是 。
下表是A、B、C三种固体物质在不同温度时的溶解度。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
|
| 溶解度/g |
A |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
| B |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
|
| C |
0.18 |
0.16 |
0.14 |
0.11 |
0.09 |
0.07 |
|
(1)从表中数据可以看出 的溶解度随温度升高而增大。
(2)若A中混有少量B,提纯A所采用的方法是 。
(3)20℃时,100gB饱和溶液中含B物质的质量 (填">""=""<")36.0g。
(4)将40℃时,A、B、C三种物质的饱和溶液降温至20℃,溶液中溶质的质量分数保持不变的是 。
根据下表回答问题.
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
溶解度 |
A |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
51.1 |
B |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
|
(1)20℃时,将20gA放入盛有50g水的烧杯中,充分溶解后,所得溶液的质量为 g.
(2)50℃时,将等质量的A、B分别放入100g水里,充分溶解后,如图所示.
①烧杯 (填“甲”或“乙”)中的溶液一定是饱和溶液.
②乙中的溶质是 (填“A”或“B”).
③若使甲中固体完全溶解,所得溶液中溶质的质量分数 (填“一定变大”、“一定变小”、“一定不变”或“不确定”).

已知甲物质的溶解度与温度的关系如下表所示:
温度/℃ |
10 |
20 |
30 |
40 |
溶解度/g |
10.0 |
18.0 |
36.0 |
56.0 |
按如图步骤进行操作:

(1)甲属于 (填“易”或“可”)溶性物质,它的溶解度随温度的升高而 ;
(2)在A﹣E的溶液中,属于不饱和溶液的是 (填序号,下同),与B溶液的溶质质量分数相同的是 ;
(3)要使E中未溶的甲物质全部溶解,至少需要加入30℃的水 g。
几种物质的溶解度如下表所示,根据表中信息回答下列问题:
温度/℃ 溶解度/g |
0 |
20 |
40 |
60 |
80 |
100 |
Li2CO3 |
1.54 |
1.33 |
1.17 |
1.01 |
0.85 |
0.72 |
NaCl |
35.7 |
36 |
36.6 |
37.3 |
38.4 |
39.8 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
245 |
(1)溶解度随温度升高而减小的是 。(填化学式)
(2)硝酸钾固体中混有少量氯化钠固体,欲分离该混合物获得更纯的硝酸钾,可在较高温度时制成饱和溶液,然后 。
(3)配制20℃时氯化钠的饱和溶液68g,需水 g。
如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
(1)P点含义 ;
(2)t 2℃时,将15gA物质放入50g水中,充分溶解后,形成溶液的质量为 g;
(3)若A物质中含有少量的B物质,提纯A物质的方法是 (填"降温结晶"或"蒸发结晶");
(4)t 3℃时,将A、B、C三种物质的饱和溶液降温到t 1℃,三种溶液中溶质的质量分数由大到小的顺序为 。

如图1是A、B、C三种物质的溶解度曲线,请回答。
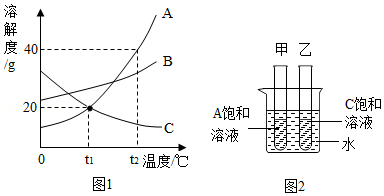
(1)t 2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为 。
(2)A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是 。
(3)t 1℃时,取等质量的A、C饱和溶液分别置于甲、乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是 。
20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3,请结合图示回答下列问题:

(1)图1中一定为饱和溶液的是 。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为 。
(3)图3中P点表示的含义是 。
水是生命的源泉,下列变化与水相关。请回答:
①二氧化碳溶于水发生反应的化学方程式是 (1) 。
②自来水厂净水过程中常用到活性炭,其作用是 (2) 。
③铁丝在氧气中燃烧时,集气瓶内放少量水的目的是 (3) 。
④除去粗盐中泥沙等难溶性杂质的实验步骤:

I. 操作a的名称是 (4) ;
II. 三个步骤都用到的玻璃仪器是 (5) 。
⑤甲和乙两种固体物质(不含结晶水)的溶解度曲线如下图所示,回答下列问题:
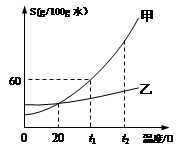
I.在 (6) ℃时,甲和乙两种物质的溶解度相等。
II.t1℃时,将50g固体甲加到50g水中,充分搅拌后所得溶液的质量为 (7) g。
III.甲的饱和溶液中含有少量的乙,由该液体得到固体甲采用的方法是 (8) 。
IV.若将甲物质的不饱和溶液变为饱和溶液,下列说法正确的是 (9) 。
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量变大
⑥下图是对20℃一定质量的丙溶液进行恒温蒸发结晶的实验过程,请回答:
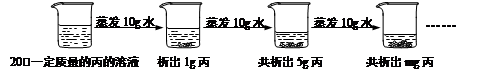
I.蒸发前原溶液是 (10) (填“饱和”或“不饱和”)溶液;m的数值是 (11) 。
II.依据上述实验,你认为丙的溶解度随温度变化的趋势是 (12) (填字母)。
A.随温度升高而增大 B.随温度升高而减小 C.无法判断
如图是甲、乙、丙三种固体物质的溶解度曲线。

① P点的含义 。
② 要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 (写出一种)。当甲溶液中含有少量乙时,可采用 的方法提纯甲。
③ t2℃时,将30 g甲物质放入50 g水的烧杯中,所得溶液溶质的质量分数为 (精确到0.1)。若烧杯内物质升温到t3℃(不考虑水蒸发),溶液中变化的是 。
Ⅰ.溶质的质量 Ⅱ.溶剂的质量 Ⅲ.溶质的质量分数
④ t2℃时,在含有50 g水的甲和乙的饱和溶液中,分别加入m g甲和m g乙,升温至t3℃,甲完全溶解,乙仍有剩余,则m的质量范围是 。
如图是甲、乙两种物质的溶解度曲线,请结合图回答问题:
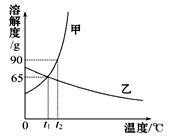
(1) ℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是 (填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是 。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数 乙溶液的溶质质量分数。(填“大于”“等于”或“小于”)。
(5)小明同学用甲物质进行以下实验:
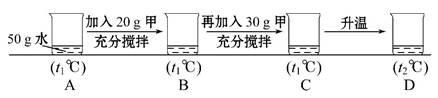
①实验过程中,B、C、D对应的溶液为不饱和溶液的是 。
②向B对应的溶液中再加入30 g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是 。
硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:

(1)t1℃时,两物质中溶解度较大的是 ;
(2)可使硝酸钾从其t2℃时饱和溶液中结晶析出的方法是 ;
(3)t2℃时,将100g水加入盛有50g氯化钾的烧杯中,充分溶解后得到氯化钾的 (填“饱和”或“不饱和”)溶液。保持温度不变,往该烧杯中再加入10g水,充分搅拌后,氯化钾溶液的溶质的质量分数 (填“变大”、“不变”或“变小”);
(4)欲配制溶质的质量分数为20%的硝酸钾溶液,应满足的温度范围是 。
甲、乙、丙三种物质的溶解度曲线如图所示.据图回答:

30℃时,甲、乙、丙三种物质的溶解度由大到小的顺序为 ;要使接近饱和的丙物质溶液变为饱和,可采取的一种措施是 ;50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是 ,所得溶液中溶质质量分数最小的是 [50℃时,30g乙物质加入到50g水中不断搅拌,所得溶液的质量是 .
如图是A、B、C三种固体物质的溶解度曲线。

(1)P点的含义: ;
(2)当温度为t2℃时,A、B、C三种物质的溶解度由小到大的顺序 。
(3)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为 。
(4)当A中含有少量B时,为了得到纯净的A,可采用 的方法。
人类的日常生活和工农业生产离不开水。请回答:
(1)水__ ________(填“属于”或“不属于”)人类所需的六大基本营养素之一。
(2)含有较多可溶性钙、镁化合物的水叫做____________(填“软水”或“硬水”)。
(3)下列净化水的单一操作中,相对净化程度较高的是__________ _(填字母)。
A.静置沉淀 B.吸附沉淀 C.蒸馏
(4)水在通电的条件下可以分解,写出该反应的化学方程式__ __。
(5)甲和乙两种固体物质的溶解度曲线如右下图所示,回答下列问题:

①在__ __℃时,甲和乙两种物质的溶解度相等。
②将t1 ℃时等质量的甲和乙两种物质的饱和溶液分别降温到0 ℃,析出固体质量较少的是______(填“甲”或“乙”)。
③t2 ℃时,将60 g甲物质放入100 g水中,充分搅拌,所得溶液的溶质质量分数w(甲)与同温下乙物质的饱和溶液的溶质质量分数w(乙)大小关系为________ __(填字母)。
A.w(甲)<w(乙) B.w(甲)>w(乙)
C.w(甲)=w(乙) D.无法确定