右图为甲、乙、丙三种物质的溶解度曲线。

(1)图中
点表示的乙溶液为(填"饱和"或"不饱和")溶液;
(2)
℃时,将
甲物质加入到
水中,所得溶液溶质质量分数为;
(3)
℃时,将等质量甲和丙的饱和溶液降温到
℃,所得溶液质量大小关系为:
甲丙(填"<"、">"或"=");
(4)将
℃时丙的不饱和溶液变为饱和溶液可采取的方法为(填一种即可)。
水在生活、生产和化学实验中起着十分重要的作用.
(1)水的净化.向浑浊的天然水中加入明矾,静置一段时间后,取上层液体过滤,得到略带颜色的液体。实验中加入明矾的作用是,过滤操作中用到的玻璃仪器有烧杯、玻璃棒、(填仪器名称),其中玻璃棒的作用是。
(2)水的组成.用如图1实验装置可以证明水的组成,检验
处气体的方法是。
(3)水的用途.水是常用的溶剂.如图2为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线。
①
,若将
甲物质放入
水中充分溶解得到g溶液。
②若固体乙中混有少量固体甲,提纯乙的方法是:溶解、过滤。
③将
时丙的饱和溶液降温到
时,丙溶液为(填"饱和"或"不饱和")溶液,溶质质量分数(填"变大"、"变小"或"不变")。
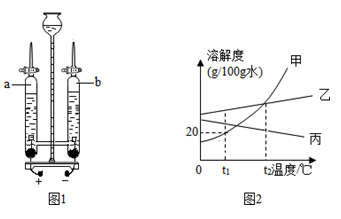
图示可以简明、直观的表达一些信息,是化学学习的一种重要手段.仔细读图,根据图示完成下列各题。

(1)图1是表示;
(2)图2是元素周期表中氙元素的某些信息,据此可知,氙的相对原子质量是;
(3)图3是氯原子的结构示意图,其中,x=;该原子在化学反应中容易(填"得"或"失")电子;
(4)图4是a、b、c三种固体物质的溶解度曲线.t1℃时三种物质的溶解度由大到小的顺序是;t2℃时c的饱和溶液温度升高到t3℃时,溶液为(填"饱和"或"不饱和")溶液.
某化学小组初步探究"氢氧化钠溶液与盐酸发生中和反应时溶液温度的变化情况".
实验用品:37%的浓盐酸(密度为
)、10%的氢氧化钠溶液、蒸馏水、量筒、温度计
实验一:配制100
10%的盐酸(密度为
)
实验步骤
(1)计算:需要37%的浓盐酸的体积为
(精确到0.01
,下同);需要蒸馏水的体积为
(水的密度为
)
(2)量取浓盐酸和蒸馏水。
(3)混合配制。
实验二:在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸(室温下),反应中溶液温度的变化如下:

(1)表中
的值为.
(2)试绘出溶液温度变化与加入盐酸体积之间的关系图.
(3)根据所绘曲线分析,加入盐酸的体积在0~10
时,溶液温度变化的趋势及其原因是。
(4)其他条件不变,若改用20%的盐酸进行滴加,结合对上述曲线的分析,大胆猜想新曲线最高点的位置(不考虑溶液密度和比热容的变化及热量散失等影响因素)。
横坐标及猜想理由:;
纵坐标及猜想理由:。

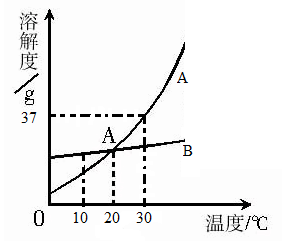
下图是两种物质的溶解度曲线,下列说法正确的是( )

| A. | 甲的溶解度大于乙的溶解度 |
| B. | ℃时等质量甲、乙两种物质的饱和溶液中溶质质量相等 |
| C. | ℃时等质量的甲、乙两物质的饱和溶液降温至 ℃时,两溶液中溶质质量分数相等 |
| D. | 氧气的溶解度随温度变化的规律与图中乙相似 |
如图是
、
、
三种固体物质的溶解度曲线图,请回答:

(1)
、
、
三种物质的溶解度受温度影响最大的是;
(2)t1℃时
的溶解度(填">"、"<"或"=")
的溶解度;
(3)在t2℃时,将15g
物质加入到50g水中,充分搅拌后,所得溶液中溶质的质量分数为。
A、B两种固体物质的溶解度曲线如图所示,据图回答下列问题:
(1)分别将相同质量的
、
饱和溶液,从
降到
,析出晶体较多的是(填"
"或"
")。
(2)
时,将
物质
溶于
水中,所得溶液中溶质的质量分数为。
右图是甲、乙两种固体物质的溶解度曲线,回答下列问题:

(1)当温度为℃时,甲、乙两种物质的溶解度相等;
(2)
℃时,在100g水中加入60g甲,形成溶液(填"饱和"或"不饱和")。此时溶液中溶质的质量分数为(保留一位小数)
根据下列溶解度表和溶解度曲线回答问题.
| 温度/℃ |
0 |
20 |
40 |
60 |
| 溶解度/ | 13.3 |
31.6 |
63.9 |
110 |
(1)图中表示硝酸钾溶液溶解度曲线的是(填"甲"、"乙"或"丙")。

(2)60℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是。
(3)60℃时,取甲、乙、丙各40
分别加入100
水中充分溶解后,能形成饱和溶液的是。
(4)将20℃的
饱和溶液升温到60℃(不考虑水分蒸发),其溶质的质量分数(填"变大"、"变小"或"不变")。
如图是甲、乙两种固体物质的溶解度曲线.

(1)
℃时,甲物质的溶解度为;
(2)分析
℃时,将10g乙物质放入100g水中,充分溶解后所得的溶液是(填"饱和"或"不饱和")溶液。欲使
℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法(任填一种方法)。
下图是
三种固体物质的溶解度曲线,请回答下列问题:

(1)溶解度受温度影响最小的是(填"
"或"
");
(2)
℃时
的溶解度为;
(3)
℃时,
的溶解度由大到小的顺序是;
(4)
℃时将
物质加入
水中充分溶解后,所得溶液是溶液(填"饱和"或"不饱和");
如图是氯化钠和硫酸钠的溶解度曲线,看图后回答问题:

(1)的溶解度收温度影响变化不大。
(2)温度不变时,若将氯化钠的不饱和溶液变为饱和溶液可采取的方法是。(填一种即可)
(3)40℃时,将30
硫酸钠固体加入到50
水中充分溶解,所得溶液的质量是。
(4)用降温结晶的方法提纯含少量杂质氯化钠的硫酸钠,最佳的温度范围是℃以下,理由是。
如图是甲、乙两种固体物质的溶解度曲线,回答下列问题:

(1)
时,甲物质的溶解度乙物质的溶解度(填"
"、"
"、"
");
(2)
时,将
克甲物质放入
克水中,形成的溶液是(填"饱和溶液"或"不饱和溶液");
(3)若固体甲中含有少量的乙,可用方法提纯甲(填"蒸发结晶"或"降温结晶");
(4)
时,将等质量的甲和乙分别溶解于水恰好形成饱和溶液时,甲物质需要水的质量乙物质需要水的质量(填"
"、"
"、"
")。
亚硝酸钠( )有毒、有咸味,外形与食盐相似。人若误食会引起中毒, 、 的溶解度曲线如图所示。
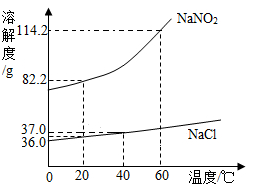
请回答下列问题:
(1)某同学设计的鉴别
、
固体的方案如下:20℃,取6.0 克
和6.0克
分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL)。用玻璃棒充分搅拌后,观察现象。你认为此方案是否可行?(填"可行"或"不可行")。
(2)除去
固体中混有的少量
,实验步骤:加水溶解、蒸发浓缩、,然后过滤、洗涤、干燥。
(3)20℃时,将182.2克
饱和溶液蒸发掉50克水,再降温到20℃,可析出晶体的质量为。
(4)分别将60℃时等质量的
、
的饱和溶液降温到20℃,析出晶体最多的是(填"
"或"
")。
下图为甲、乙、丙三种物质的溶解度曲线。回答下列问题:

(1)
点的意义是。
(2)
℃时,向30g甲物质中加入50g水,充分溶解后,所得溶液质量为,将其升高到
℃时,所得溶液中溶质和溶液质量比为。
(3)
℃时,把等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为。
(4)将
℃时甲、乙、丙三种物质的饱和溶液降温至
℃,所得溶液的溶质质量分数由大到小的顺序为。