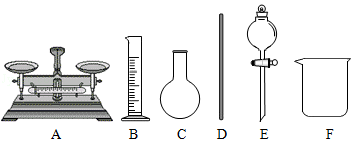
下列对实验现象的描述或实验操作正确的是( )
| A. |
镁条在空气中燃烧,有大量黑色固体生成 |
| B. |
为加快过滤速度,用玻璃棒搅拌滤纸上的悬浊液 |
| C. |
葡萄糖溶液与新制氢氧化铜混合加热至沸,出现红色沉淀 |
| D. |
配制一定体积的稀硫酸时,将水倒入盛有浓硫酸的量简中,并搅拌 |
粗盐提纯和溶液配制的实验中涉及以下实验操作,其中不正确的是( )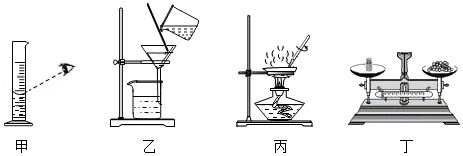
A.用图甲所示仪器量取液体
B.用图乙所示装置过滤悬浊液
C.用图丙所示装置蒸发溶液
D.用图丁所示仪器称量固体
请回答下列实验问题:
(1)现提供如图装置
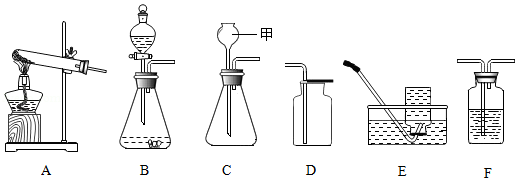
①上图C装置中,甲仪器的名称是 。
②实验室将双氧水加入二氧化锰粉末制取氧气,发生装置是 (填序号),反应的化学方程式为 ,若用E装置收集氧气,当有 时,开始收集气体。
③实验室可以按照“B→F→F→真空气囊”的装置顺序制取纯净的CO2气体,B装置中发生反应的化学方程式为 ,第一个F装置盛放试剂的作用是 ,第二个F装置盛放的试剂为 。
(2)实验室用氯化钠固体配制50g15%的氯化钠溶液的步骤有:计算、称取氯化钠、量取水、溶解、转移。
①在溶解过程中,玻璃棒的作用是 。
②下列操作中,可能导致配制氯化钠溶液的溶质质量分数偏大的是 (填序号)。
a.称取时,将氯化钠置于托盘天平的右盘
b.量取水时俯视读数
c.用已有少量水的烧杯溶解氯化钠
d.转移时,有少量溶液溅出
配制50g质量分数5%的KNO3溶液,作为无土栽培所需的营养液,溶解过程中KNO3的质量分数随时间变化关系如图所示,观察图象,分析形成这种结果的原因是( )
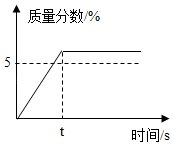
A.所用KNO3固体中含有水分
B.量筒量水时俯视刻度线
C.KNO3固体溶解前所用烧杯内有水
D.配好的溶液装瓶时部分液体洒落在试剂瓶外
实验室配制一定溶质质量分数的氢氧化钠溶液,部分操作如图所示,其中不正确的是( )
A.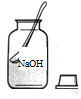
B.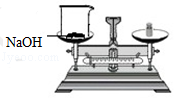
C.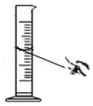
D.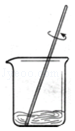
某学生要配制一定溶质质量分数的NaOH溶液,实验操作如图所示,其中正确的是( )
A. 取用NaOH固体B.
取用NaOH固体B. 称量NaOH固体
称量NaOH固体
C.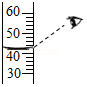 量取一定体积的水D.
量取一定体积的水D. 溶解NaOH固体
溶解NaOH固体
某同学选用氢氧化钠固体与水配制20g溶质质量分数为10%的氢氧化钠溶液,下列说法错误的是( )
①需称取氢氧化钠固体2.0g
②称量前托盘天平应先检查游码是否归零,并调节平衡
③用托盘天平称量氢氧化钠固体时,为防止污染托盘,可将氢氧化钠放在纸上称量
④选用250mL量筒量取18mL的水
⑤存放溶液时,为确保数据准确,将试剂瓶用蒸馏水清洗后,立即倒入所配溶液封存
A.①④B.③④⑤C.④⑤D.②③⑤
以下是初中化学一些基本实验,请根据实验内容回答下列问题:
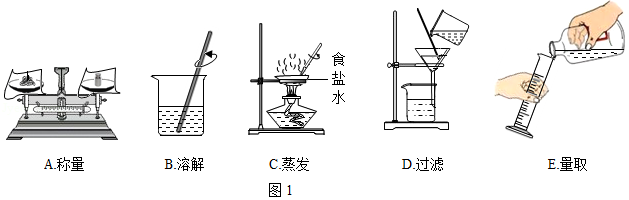
(1)利用如图1进行粗盐中难溶性杂质去除和配制一定质量分数氯化钠溶液的实验。
①粗盐中难溶性杂质去除的主要操作顺序是 (填字母序号);
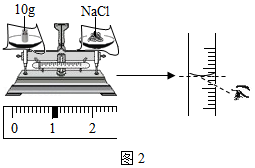
②配制11%的氯化钠溶液100g。如按如图进行称量和量取,其它操作均规范无误,最终导致配制的氯化钠溶液的溶质质量分数 (填“大于”、小于”或“不能确定”)11%。
(2)如图为某小组探究金属化学性质的两组实验。
实验I |
实验Ⅱ |
|
|
①实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 ;
②写出实验Ⅱ中C试管内反应的化学方程式 ;
③实验Ⅱ中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是 (填字母序号)。
李华同学用如图所示的仪器和药品,制备氧气并对燃烧的条件进行探究,请回答下列问题:

(1)A中生成氧气的化学方程式是 。
(2)实验开始,用30%的过氧化氢溶液配制100g 6%的过氧化氢溶液,量取水时,若读数如图2所示,则所配溶液中过氧化氢的质量分数 (填“>”、“<”或“=”)6%.(水的密度可近似看作1g/cm3)

(3)对比B、C装置中的实验现象,说明燃烧的条件之一是 。
(4)实验时,D不燃烧,可以采用 方法让D中的白磷燃烧。
(5)E中NaOH溶液的作用是 。
溶液对动植物的生理活动和人类的生产,科研活动具有重要意义
(1)室温下,某实验小组欲配制200g溶质质量分数为10%的碳酸钠溶液,按如图所示步骤操作。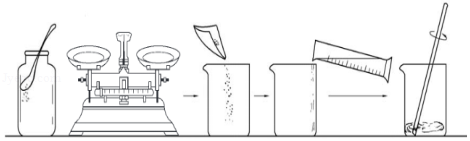
请填空:
①计算:需Na2CO3 g,水 mL(室温时,水的密度的为1.0g/mL)。
②称量:调节天平平衡后称量所需的碳酸钠粉末时,发现托盘天平的指针偏左,此时应 (填写序号A、B、C之一)。
A,调节天平平衡螺母 B.增加适量Na2CO3 C.减少适量Na2CO3
③配制溶液:用量筒量取所需的水,倒入盛有Na2CO3的烧杯中,用玻璃棒搅拌。搅拌的目的是 。
这样得到的溶液即是200g溶质质量分数为10%的Na2CO3溶液。
(2)室温下,实验小组的同学把上述配制的Na2CO3溶液,逐滴加入到盛有100g CaCl2不饱和溶液的烧杯中,生成沉淀的质量与加入Na2CO3溶液的质量关系如图所示。请根据题意回答下列问题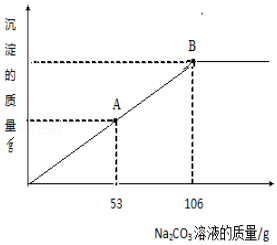
①当滴入Na2CO3溶液53g时(即图中A点),烧杯中溶液里含有的溶质的为 (写化学式)。
②当滴入10%的Na2CO3溶液106g时(即图中B点),恰好完全反应,试通过计算,求此时烧杯中所得不饱和溶液的质量。
小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为( )
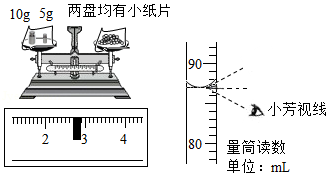
A.12.4%B.17.2%C.16.9%D.12.5%
下列关于溶液说法正确的是( )
A.将硫酸钠和汽油放入水中,充分搅拌后都能形成溶液
B.把30%的硝酸钾溶液均分成两份,每份溶液的溶质质量分数为15%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制100g10%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
实验室配制100g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是( )
A.若在量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%
B.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解速率
C.实验的步骤为计算、称量、量取、溶解、装瓶贴标签
D.量取水时,用规格为l00mL的量筒
(1)"84消毒液"是现在家庭中常用的消毒剂和漂白剂(能使酸碱指示剂等有机色素褪色的物质),它的有效成分是NaClO."84消毒液"属于 (填"纯净物"或"混合物"),该消毒液呈碱性,我们 (填"能"或"不能")用pH试纸来测此溶液的pH,原因是 。(若"能"此空可不填)
(2)"84消毒液"制取原理为:Cl 2+2NaOH=NaClO+X+H 2O,则X的化学式为 。观察上述反应中物质及化合价变化的特点,硫与氢氧化钠溶液在加热条件下的反应与此类似,请填出空白处的物质的化学式:S+NaOH  Na 2SO 3+ +H 2O(未配平)
Na 2SO 3+ +H 2O(未配平)
(3)若配制"84消毒液"需要100g质量分数为a%的NaOH溶液,实验室配制该NaOH溶液,需要用到图中的玻璃仪器为 (填字母编号)。在配制过程量取水时,若仰视读数,会导致所配溶液溶质质量分数 (填"偏大"、"偏小"或"不变")。