配制70克16%的NaCl溶液,下列操作会使所配溶液溶质质量分数大于16%的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
某化学课外兴趣小组欲配制80g质量分数为12%的氢氧化钠溶液来制作“叶脉书签”。
(1)需要氢氧化钠固体的质量为 g。
(2)称量时,氢氧化钠固体应放在 (填“滤纸”或“烧杯”)中。
(3)下列说法或操作正确的是 (填字母序号)。
A、配制该溶液时所需的玻璃仪器中不包括玻璃棒
B、用量程为100mL的量筒量取所需要的水
C、将称量好的固体倒入装有水的量筒中溶解
(4)在量取水的体积时,若采用仰视的方法读数,则所配制的氢氧化钠溶液中溶质的质量分数将 (填“偏大”或“偏小”)。
(5)某同学用蒸馏水润湿了的pH试纸来测定配制好的溶液的pH值时,他测得的结果会 (填“偏大”、偏小”或“不变”)。
(6)该兴趣小组的同学提出还可以用配制好的氢氧化钠溶液和稀盐酸进行中和反应实验,具体操作如图:

在烧杯中加入10mL的氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液呈 色。接着加入一定量的稀盐酸,用玻璃棒搅拌后发现溶液为无色,此时 (填“能”或“不能”)得出两者恰好中和的结论。以下操作及实验现象能证明加入的盐酸为过量的是 (填字母序号)。
A、加入少量铁粉,无明显现象
B、滴加紫色石蕊溶液,搅拌后溶液变蓝
C、加入碳酸钠溶液,产生气泡
配制一定质量分数的NaCl溶液和粗盐中难溶性杂质去除实验均不需用到的玻璃仪器是( )
A.玻璃棒B.烧杯C.漏斗D.试管
某同学配制25g 3%的NaCl溶液,整个操作过程如图所示。

回答下列问题:
(1)配制溶液的正确操作顺序为 (填序号),其中操作错误的是 (填序号)
(2)用量筒量取液体时,读数时视线要与量筒内 保持水平。
(3)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是 。
配制一定溶质质量分数的氯化钠溶液的过程如图所示:

(1)写出图中标号a仪器的名称: 。
(2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠 g,水 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 盘。(填"左"或"右")
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有 。(填序号)
A.称量时,药品与砝码放反了B.量取水的体积时,仰视读数C.装瓶时,有少量溶液洒出
(6)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
规范操作是实验成功的前提。请按要求回答下列问题:
(1)“粗盐中难溶性杂质的去除”实验中,玻璃棒的作用有:转移、 。
(2)“一定溶质质量分数溶液的配制”实验的基本步骤包括:计算、 、装瓶保存。
(3)利用pH试纸检验溶液的酸碱性,正确的操作应是 。
如图是实验室常用的一些仪器。
(1)根据以下实验要求,选择图中合适仪器,将对应的字母填在相应的横线上。
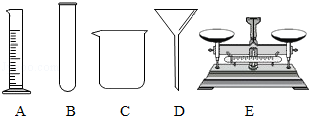
①用固体氯化钠配制50g溶质质量分数为10%的氯化钠溶液 ;
②过滤粗盐水 。
(2)除了图中的仪器,(1)中的①、②两个实验都还要用到的一种仪器是 (填仪器名称)。
(3)若(1)中的①实验配制的氯化钠溶液溶质质量分数偏小,请你分析可能的原因是 (写一条即可)。
在“一定溶质质量分数的氯化钠溶液配制”实验活动中,下列操作正确的是( )
A. 取药B.
取药B. 称量
称量
C. 量取D.
量取D. 溶解
溶解
在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
水与我们的生活息息相关。请回答下列问题:
(1)城市居民生活用水,主要靠自来水厂供给。在自来水厂里,水的净化过程中常加入氯气,其目的是 。
(2)生活中常用 检验饮用水是硬水还是软水。
(3)欲配制100g 10%的氯化钠溶液,下列说法不正确的是 (填字母序号)。
A.用蒸馏水洗涤试剂瓶后,立即盛装配制好的氯化钠溶液
B.用100mL量筒量取所需要的水
C.若将100g 10%的氯化钠溶液稀释成5%的氯化钠溶液需加入90g水
D.氯化钠固体溶解时,需用玻璃棒搅拌,目的是增大其在水中的溶解度
(4)下列做法正确的是 (填字母序号)。
A.生活中用淘米水浇花
B.农业上合理使用农药和化肥
C.净水器中加入活性炭除去水中异味
D.稀释浓硫酸时,将水倒入盛有浓硫酸的烧杯中
实验室用氯化钠和水配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.实验步骤:计算、量取、溶解、装瓶、贴签
B.量取水时,用规格为50mL的量筒
C.实验过程中玻璃棒搅拌的作用是散热
D.若在量取水时俯视读数量取,则配制溶液的溶质质量分数小于6%
利用98%的浓硫酸,配制一定溶质质量分数的稀硫酸,下列描述正确的是( )
A.实验的主要步骤是计算、称量、量取、溶解
B.用量筒量取所需的水,注入盛有浓硫酸的烧杯中
C.实验中用到的玻璃仪器只有烧杯、量筒和胶头滴管
D.量取浓硫酸时仰视读数,会使配得的溶液溶质质量分数偏大
下列是初中化学常见的实验。请回答下列问题
(1)图A所示实验结束后,进入集气瓶中水的体积小于瓶内原气体体积的五分之一,造成该现象的原因是 (答出一条即可)。
(2)图B所示实验观察到木屑先燃烧,燃烧的顺序说明燃烧的条件之一是 。
(3)图C所示实验不能验证质量守恒定律的原因是 。
(4)配制一定质量分数的氯化钠溶液,按图D所示量取溶剂,其他操作均正确,最终导致配制的溶液溶质的质量分数 (填“偏大”、“偏小”或“不变”)。
配制50g溶质质量分数为15%的氯化钠溶液,不需要用到的仪器是( )
A.集气瓶B.烧杯C.玻璃棒D.量筒
生活生产中,一种或几种物质分散到水等物质里的现象广泛存在。
(1)常温下,在密闭容器中的蔗糖溶液里,溶液下半部分的甜度与上半部分的甜度的关系是 (填“相同”或“下半部分高”)。
(2)用氯化钠固体和蒸馏水配制50g 15%的氯化钠溶液时,不需要的仪器是 (填“天平”“烧杯”或“蒸发皿”)。
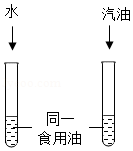
(3)常温下,某同学为探究同一物质在不同溶剂中的溶解性不同,设计了如图所示的实验装置,实验时除了要控制温度相同、试管大小规格相同、加入水与汽油的体积相同外,还要控制食用油的 相同。
(4)事实证明,CaCl2溶于水时能全部解离为自由移动的Ca2+和Cl﹣,若某CaCl2溶液中的Ca2+为a个,则应对的Cl﹣为 个。