实验室按如图步骤配制100g质量分数为22%的蔗糖溶液。
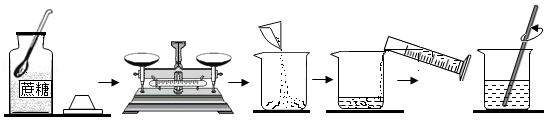 回答下列问题:
回答下列问题:
(1)所需蔗糖的质量为 。
(2)用规格为 (填“50”、“100”或“500”)mL的量筒量取 mL蒸馏水倒入盛有蔗糖的烧杯中进行溶解。(水的密度约为1g/cm3)
(3)溶解时玻璃棒的作用是 。
(4)下列情况会导致所配溶液中溶质的质量分数偏高的是 (填字母序号)。
A.蔗糖中混有少量杂质
B.称量时蔗糖和砝码位置放反了(使用了游码)
C.用于溶解蔗糖的烧杯洗净后残留有少量的水
D.用量筒量取水时,俯视读数
配制100g质量分数为16%的Na2CO3溶液,用于演示灭火器原理。回答下列问题。
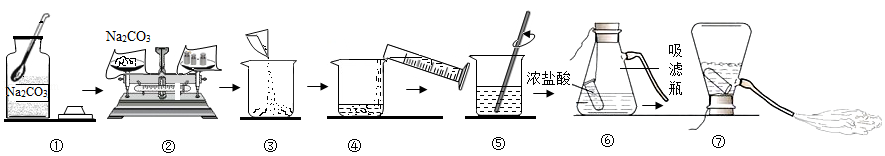
(1)计算Na2CO3的质量为 g,称量Na2CO3的仪器名称是 。
(2)20℃时,Na2CO3的溶解度为21.5g,⑤中的溶液 (填“是”或“不是”)该物质的饱和溶液。
(3)将烧杯中溶液倒入吸滤瓶的操作是 ,从橡胶管喷出大量液体的原因是 。
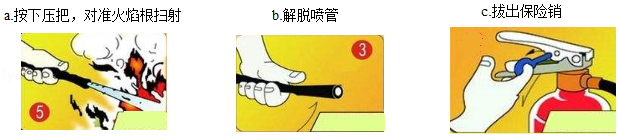
(4)酒精(C2H5OH)可作燃料,在空气中完全燃烧的化学方程式是 。酒精燃烧失火,可用干粉灭火器灭火。NaHCO3是干粉的主要成分,俗称是 。用干粉灭火器灭火的正确操作顺序是 → → (填序号)。
"84消毒液"是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)"84消毒液"中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌"84消毒液"进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)"84消毒液"不能与洁厕灵混合使用,因为"84消毒液"里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
| 浓度(mg/m 3) |
对人体的影响 |
| 3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
| 120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
| 40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米 3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl 2↑+H 2O)
正确的操作是实验成功的保证。
(1)如图甲所示,实验室稀释浓硫酸时,①处的试剂是 (填字母序号),用玻璃棒不断搅拌的作用是 (填字母序号)。
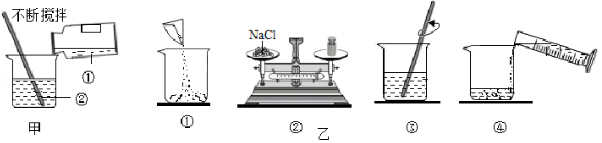
A.浓硫酸
B.水
C.引流
D.防止局部温度过高,造成酸液飞溅
(2)实验室配制一定溶质质量分数的氯化钠溶液的操作过程如图乙所示,正确的操作顺序是 (填字母序号)。
A.①②③④
B.②①④③
C.②①③④
请根据如图回答相关问题:

(1)实验A滤液仍然浑浊,可能的原因是 (答一点即可)。
(2)实验B观察到烧杯②中溶液变红,说明分子具有的性质是 。
(3)实验C中,将大小相同的白磷分别放入冷水和热水中,通入空气,观察现象。此实验说明燃烧的条件之一是 。
(4)配制溶液时,按图D所示量取溶剂,其他操作均正确,最终导致配制的溶液溶质质量分数 (填"偏大"或"偏小")。
“二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。(杂质不参加反应)
(1)实验时需配制50g 5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制。则需称量氢氧化钠固体的质量为 g。
(2)取20g废液样品于烧杯中,向其中逐滴加入5%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液16g。计算废液中盐酸的溶质质量分数。(写出计算过程)
(3)恰好完全反应时烧杯中的溶液所含粒子数目关系:Na+ Cl﹣. (填“>”、“=”或“<”)。
某工厂利用废铁屑与废硫酸反应制取绿矾(FeSO4•7H2O)。
(1)绿矾中铁原子与氧原子个数比为 。
(2)现有废硫酸4.9t(硫酸的质量分数为20%)与足量的废铁屑反应,理论上可生产出绿矾的质量是多少?(请写出计算过程,结果保留三位有效数字,下同)
(3)若配制100g质量分数为20%的稀硫酸溶液,需质量分数为98%的浓硫酸的体积是多少?(已知:质量分数为98%的浓硫酸的密度为1.84g/cm3)。
黄铜(铜和锌的合金)因性能优良,被广泛用于制作钱币、饰品和生产中,铜的质量分数在59%﹣65%之间的黄铜性能优良。兴趣小组为了解某黄铜螺母的材料性能进行如下实验:取多个黄铜螺母放入烧杯中,另取80克19.6%的稀硫酸,分四次等质量加入,每次均充分反应,实验过程数据记录如表。
实验次数 |
1 |
2 |
3 |
4 |
稀硫酸的用量/克 |
20 |
20 |
20 |
20 |
剩余固体的质量/克 |
20.0 |
17.4 |
14.8 |
13.5 |
分析上述数据,请回答下列问题:
(1)第4次实验结束后溶液的pH 7(选填“>”“=”或“<”)。
(2)配制80克溶质质量分数为19.6%的稀硫酸,需98%的浓硫酸(密度为1.84克/厘米3)多少毫升?(精确到小数点后一位)
(3)通过计算说明该黄铜螺母的材料性能是否优良。
某化学课外兴趣小组欲配制80g质量分数为12%的氢氧化钠溶液来制作“叶脉书签”。
(1)需要氢氧化钠固体的质量为 g。
(2)称量时,氢氧化钠固体应放在 (填“滤纸”或“烧杯”)中。
(3)下列说法或操作正确的是 (填字母序号)。
A、配制该溶液时所需的玻璃仪器中不包括玻璃棒
B、用量程为100mL的量筒量取所需要的水
C、将称量好的固体倒入装有水的量筒中溶解
(4)在量取水的体积时,若采用仰视的方法读数,则所配制的氢氧化钠溶液中溶质的质量分数将 (填“偏大”或“偏小”)。
(5)某同学用蒸馏水润湿了的pH试纸来测定配制好的溶液的pH值时,他测得的结果会 (填“偏大”、偏小”或“不变”)。
(6)该兴趣小组的同学提出还可以用配制好的氢氧化钠溶液和稀盐酸进行中和反应实验,具体操作如图:

在烧杯中加入10mL的氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液呈 色。接着加入一定量的稀盐酸,用玻璃棒搅拌后发现溶液为无色,此时 (填“能”或“不能”)得出两者恰好中和的结论。以下操作及实验现象能证明加入的盐酸为过量的是 (填字母序号)。
A、加入少量铁粉,无明显现象
B、滴加紫色石蕊溶液,搅拌后溶液变蓝
C、加入碳酸钠溶液,产生气泡
配制一定溶质质量分数的氯化钠溶液的过程如图所示:

(1)写出图中标号a仪器的名称: 。
(2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠 g,水 g。
(3)称量氯化钠时,氯化钠应放在托盘天平的 盘。(填"左"或"右")
(4)溶解过程中玻璃棒的作用是 。
(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有 。(填序号)
A.称量时,药品与砝码放反了B.量取水的体积时,仰视读数C.装瓶时,有少量溶液洒出
(6)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是 g。
如图是实验室常用的一些仪器。
(1)根据以下实验要求,选择图中合适仪器,将对应的字母填在相应的横线上。
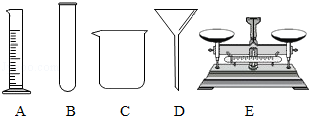
①用固体氯化钠配制50g溶质质量分数为10%的氯化钠溶液 ;
②过滤粗盐水 。
(2)除了图中的仪器,(1)中的①、②两个实验都还要用到的一种仪器是 (填仪器名称)。
(3)若(1)中的①实验配制的氯化钠溶液溶质质量分数偏小,请你分析可能的原因是 (写一条即可)。
下列是初中化学常见的实验。请回答下列问题
(1)图A所示实验结束后,进入集气瓶中水的体积小于瓶内原气体体积的五分之一,造成该现象的原因是 (答出一条即可)。
(2)图B所示实验观察到木屑先燃烧,燃烧的顺序说明燃烧的条件之一是 。
(3)图C所示实验不能验证质量守恒定律的原因是 。
(4)配制一定质量分数的氯化钠溶液,按图D所示量取溶剂,其他操作均正确,最终导致配制的溶液溶质的质量分数 (填“偏大”、“偏小”或“不变”)。
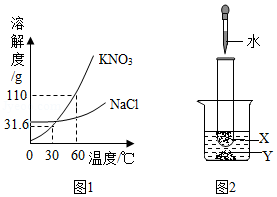
溶液在日常生活、工农业生产和科学研究中具有广泛用途。
(1)KNO3属于复合肥,所含的营养元素有 ,溶质质量分数为3%的KNO3溶液常用作无土栽培的营养液,配制100g该营养液需要的溶质是 ,其质量为 g,配制时常用玻璃棒搅拌,目的是 。
(2)某KNO3固体(混有少量NaCl),要用它配制上述营养液,需在配制前进行提纯(图1为溶解度曲线),60℃时,KNO3的溶解度为 g,将该固体溶于水配制为接近饱和的溶液,可采用降温结晶的方法提纯KNO3,其理由是 。
(3)探究温度对溶解度的影响,如图2所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20℃Y的饱和溶液(有少量Y的固体剩余),往试管中滴入适量水,烧杯中固体逐渐消失,写出X与Y可能的组合 。
实验是学习化学的重要手段,请结合下图所示实验回答相应问题。
|
|
|
实验一 |
实验二 |
实验三 |
(1)实验一中观察到蜡烛由低到高依次熄灭,说明二氧化碳具有的性质是 。
(2)实验二是配制50g质量分数为6%的氯化钠溶液的实验,应称取NaCI的质量为 g,某同学在量取液体体积时俯视读数,这样会使所配溶液的质量分数 6%(填“大于”,“等于”或“小于”)。
(3)实验三是电解水的实验,该实验说明水是由 组成的。
某同学配制50g 6%的氯化钠溶液,整个操作过程中如图所示,回答下列问题:
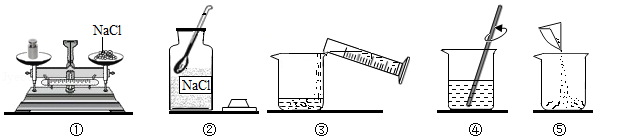
(1)配制溶液的正确操作顺序为 (填序号,下同),其中操作错误的是 。
(2)图②中盛放氯化钠固体的仪器名称是 ,需称取氯化钠 g。
(3)量水时选用的量筒的量程最合适的是 (填序号),读数时视线要与量筒内 保持水平。
A.10mLB.25mLC.50mLD.100mL
(4)取上述溶液10g加水 g,可稀释得到3%的NaCl溶液。
(5)若该同学配制的溶液溶质质量分数偏小,可能的原因是 (填序号)。
A.氯化钠固体不纯B.用生锈砝码称量
C.装瓶时有少量溶液洒出D.溶解前烧杯内有少量水