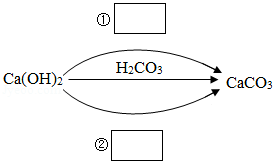
(1)化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质(填化学式)实现Ca(OH) 2一步转化为CaCO 3。
(2)某Ca(OH) 2样品部分变质为CaCO 3(假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH) 2的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸 g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
| 反应时间/min |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯总质量/g |
280.0 |
278.9 |
277.8 |
277.8 |
完全反应后,生成的CO 2气体的质量为 g。
③数据处理:计算该样品中Ca(OH) 2的质量分数(根据化学方程式的计算写出完整的计算步骤)。
室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
| 温度(℃) |
0 |
20 |
25 |
40 |
50 |
60 |
80 |
| 溶解度(g) |
69.2 |
74.5 |
76.4 |
81.8 |
85.5 |
89.4 |
98.0 |
步骤Ⅱ:配制少量CuCl 2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl 2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl 2的质量是 g。
②将称取的CuCl 2固体和20mL水倒入烧杯中, (填操作名称),直至固体完全溶解。
(2)母液中Cu 2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是 。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO 3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是 g(只列计算式,已知CuCl 2的相对分子质量为135)。
以下实验室配制一定溶质质量分数的氯化钠溶液的流程示意图.
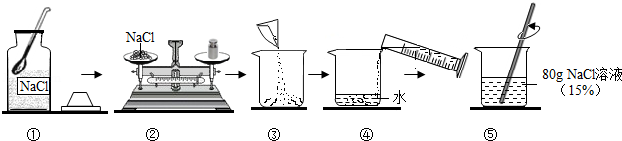
请根据示意图回答.
(1)托盘天平左盘中固体氯化钠的质量为 g,量筒中水的体积为 mL;
(2)上述溶液取10g加水40g进行稀释,所得氯化钠溶液的溶质质量分数是 .
实验室常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(l)定性检测废水
检测废水呈酸性的方法是 。
(2)配制200g质量分数为5.6%的氢氧化钾溶液
①计算
m (KOH)= g,V(H 2O)= mL(水的密度近似为1.0g•mL ﹣ 1)。
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量。然后 (按操作先后顺序,填字母),直至天平平衡。
A.向烧杯中加氢氧化钾固体 B.按需要添加砝码、移动游码 C.量取水 D.溶解 E.转移。
(3)定量测定废水
取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
①P点对应溶液中一定存在的阳离子有 (填离子符号)。
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%)。
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.l%)。

溶液在生产、生活中起着十分重要的作用。请回答下列问题:
(1)可以作为溶质的是 。
A.只有固体 B.只有液体 C.只有气体 D.气体、液体、固体都可以
(2)配制100g质量分数为16%的氯化钠溶液,所需氯化钠的质量为 ,水的体积为 mL (水的密度近似看作1g/cm 3)。
(3)甲、乙两种不含结晶水的固体物质的溶解度曲线如图1.t 1℃时,甲物质的溶解度是 。t 2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须蒸发掉较多水的是 (填"甲"或"乙")物质的饱和溶液。

(4)按图2所示装置,将液体X注入装有固体y的试管中,会导致U形管中右端液面升高。则可能的组合是 。
| 选项 |
x |
y |
| A |
水 |
氧化钙 |
| B |
水 |
硝酸铵 |
| C |
浓硫酸 |
水 |
| D |
稀盐酸 |
镁 |
根据下列实验装置或操作示意图回答问题:
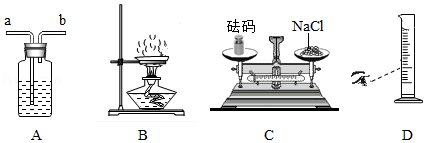
(1)用图A装置干燥O2,广口瓶内盛放的试剂是 ,气体应从 (填“a”或“b”)口进入.
(2)图B是蒸发食盐水操作,缺少的仪器是 ,组装该装置时,放置仪器的先后顺序是 (填数字序号).
①铁架台 ②铁圈 ③蒸发皿 ④酒精灯
(3)配制一定溶质质量分数的氯化钠溶液,图C中称量操作的错误之处是 .若其他操作均正确,按图D所示量取蒸馏水,则配制的氯化钠溶液浓度会 (填“偏大”“偏小”或“无影响”).
(1)下列关于实验的描述正确的是 (多选,用字母作答)
A.硫在空气中燃烧,发出明亮的蓝紫色火焰,生成无色无味的气体
B.向放置于沸水的白磷中鼓入氧气,白磷燃烧
C.用pH试纸测量氯化钠溶液,得到pH=12
D.两种不同质量分数的食盐水混合,搅拌静置,液体分层
E.在氢气还原氧化铜的实验中,固体颜色由黑色变为红色
(2)请从甲乙两题中任选一个作答,若两题均作答。按甲计分。
| 甲:粗盐中难溶性杂质的去除 |
乙:配制100g 5%的氯化钠溶液 |
| ①粗盐的溶解过程中,玻璃棒的作用是 ②过滤需用到的玻璃仪器有 ( 填字母)。 ③加热过程中当蒸发皿中 ,停止加热。 |
①称量时氯化钠应放在托盘天平的 。 ②用 (填一个字母)量取所需的水,倒入盛有氯化钠的烧杯中。 ③把配制好的氯化钠得液装入 中,盖好瓶塞,并贴上标签。 |
| ②中可供选择的仪器:A.试管 B.烧杯 C.10mL量筒 D.100mL量筒 E.胶头滴管F.漏斗 G.玻璃棒 |
|
如图是某同学配制50g溶质质量分数为15%的KNO3溶液的过程:
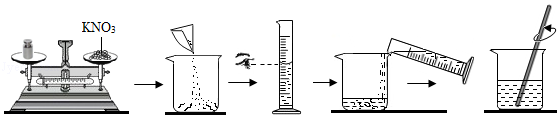
回答下列问题:
(1)配制溶液的步骤是:计算、 、量取、溶解、装瓶贴标签。
(2)指出图中的错误: ,若其他操作均正确,该操作会导致最终配制的溶液溶质质量分数 (“偏大”或“偏小”)。
(3)量取水时,应选择 (填“10mL”、“50mL”或“100mL”)的量筒,量取过程中,还需要的一种仪器是 。
(4)实验中发现硝酸钾已结块,为了较快地溶解,合理的方法有 (填数字序号)。
①将硝酸钾研碎 ②用热水溶解 ③加入更多的水 ④用玻璃棒搅拌