溶液对动植物的生理活动和人类的生产,科研活动具有重要意义
(1)室温下,某实验小组欲配制200g溶质质量分数为10%的碳酸钠溶液,按如图所示步骤操作。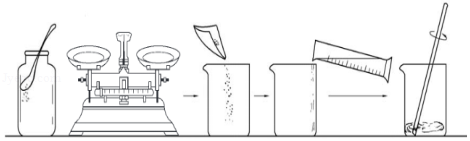
请填空:
①计算:需Na2CO3 g,水 mL(室温时,水的密度的为1.0g/mL)。
②称量:调节天平平衡后称量所需的碳酸钠粉末时,发现托盘天平的指针偏左,此时应 (填写序号A、B、C之一)。
A,调节天平平衡螺母 B.增加适量Na2CO3 C.减少适量Na2CO3
③配制溶液:用量筒量取所需的水,倒入盛有Na2CO3的烧杯中,用玻璃棒搅拌。搅拌的目的是 。
这样得到的溶液即是200g溶质质量分数为10%的Na2CO3溶液。
(2)室温下,实验小组的同学把上述配制的Na2CO3溶液,逐滴加入到盛有100g CaCl2不饱和溶液的烧杯中,生成沉淀的质量与加入Na2CO3溶液的质量关系如图所示。请根据题意回答下列问题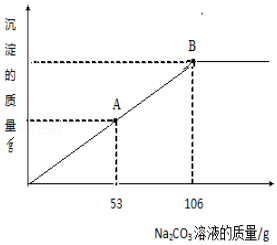
①当滴入Na2CO3溶液53g时(即图中A点),烧杯中溶液里含有的溶质的为 (写化学式)。
②当滴入10%的Na2CO3溶液106g时(即图中B点),恰好完全反应,试通过计算,求此时烧杯中所得不饱和溶液的质量。
学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。
实验一:粗盐提纯

(1)操作①中玻璃棒的作用是 ,操作③的名称为 ;
实验二:溶液配制
(2)用氯化钠固体配制100g质量分数为5%的氯化钠溶液,需要氯化钠 g;
(3)生理盐水可用于补充人体所需电解质,生理盐水中的溶质为 。
卓玛同学要用85g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”,如图是她配制氢氧化钠溶液的实验操作示意图。
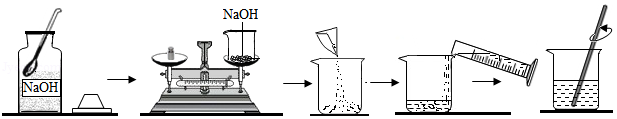
(1)卓玛同学配制该溶液时,需要称量 g氢氧化钠固体,应选择 mL(填“10”、“50”或“100”)的量筒来量取所需水的体积(水的密度可近似看作1g/cm3);
(2) 图中有一处操作有明显错误,该错误会导致所配制的氢氧化钠溶液的溶质质量分数 (填“偏大”“偏小”或“不变”)。
正确选择实验仪器是实验成功的重要保证。下面是实验室中常见的仪器,请按要求填空。
(1)配制一定溶质质量分数的氯化钠溶液,需要用到的仪器有 (填序号),还缺少的两种仪器是 (填名称);过滤粗盐水所用到的仪器有 (填序号)。
(2)实验室用锌粒和稀硫酸制取氢气,可选用上述仪器中的 (填序号)组合成发生装置。
(3)利用仪器③与⑦可组合成一个贮气装置,收集氢气(氢气难溶于水、密度小于空气)时,气体应从仪器⑦的 (填“a”或“b”)端通入,该装置还有其他的用途,请你任举一例: 。
分析处理图表中的信息是学习化学的一种重要方法,如表是NH 4Cl和KNO 3在不同温度时的溶解度数据:
| 温度/℃ |
10 |
30 |
50 |
70 |
|
| 溶解度/g |
NH 4Cl |
33.3 |
41.4 |
50.4 |
55.2 |
| KNO 3 |
20.9 |
45.8 |
85.5 |
110 |
|
根据上述数据,回答下列问题:
(1)从上表可知,50℃时,NH 4Cl的溶解度为 g.
(2)NH 4Cl和KNO 3的溶解度受温度影响比较大的物质是 (填化学式).
(3)欲配制质量分数为10%的KNO 3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和 .
(4)烧杯中A中是60℃时,含有100g水的NH 4Cl不饱和溶液,经过如图1的变化过程
(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为 g 
(5)某同学欲验证NH 4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到 现象得以验证.
A.a端液面高于b端液面
B.a端液面低于b端液面.
酸、碱、盐在生产生活中具有广泛的用途.
(l)制作“叶脉书签”需用到10%的氢氧化钠溶液.现配制50g质量分数为10%的氢氧化钠溶液.
①若用氢氧化钠固体配制,需称量氢氧化钠的质量为 g.
②用氢氧化钠固体配制10%的氢氧化钠溶液过程中需要用到的仪器除了托盘天平、药匙、量筒、烧杯、胶头滴管、试剂瓶外,还需要 .
③下列操作正确的是 (填字母).
A.称量氢氧化钠固体时,左盘放砝码
B.在托盘天平的左右托盘上垫滤纸称量氢氧化钠固体
C.将准确称量的氢氧化钠固体放入装有水的量筒中溶解
D.将配制好的氢氧化钠溶液装入试剂瓶中,塞好瓶塞并贴上标签
④若用20%的氢氧化钠溶液加水(水的密度为lg/cm3)配制50g质量分数为10%的氢氧化钠溶液,需20%的氢氧化钠溶液的质量为 g;配制时应选用 mL的量筒量取水(填“10”或“50”).
(2)某固体粉末可能含有碳酸钙、硫酸钠、氯化钠、氯化钡、硫酸铜中的一种或几种.为确定该固体粉末的成分,进行了如下实验:

回答下列问题:
①反应I 的化学方程式为 .
②白色沉淀C是 (填化学式).
③原固体粉末中一定不含 (填化学式).
溶液在日常生活、工农业生产和科学研究中具有广泛的用途。
(1)生理盐水是医疗上常用的一种溶液,其溶质是 (填化学式)
(2) 在盛有水的烧杯中加入以下某种物质, 形成溶液的过程中温度上升。 这种物质是 (填字母)。
A.氯化钠 B.硝酸铵 C.氢氧化钠
(3)某同学在实验室用氯化钠固体和蒸馏水配制50g质量分数为6%的氯化钠溶液时,涉及以下实验步骤:
①溶解 ②称量和量取③计算④装入试剂瓶贴好标签。
配制上述溶液正确的实验步骤顺序是 (填序号)
(4)某注射用药液的配制方法如下:
①把1.0g药品溶于水配制成4.0mL溶液a;
②取0.1mL溶液a,加水稀释至1.0mL,得溶液b;
③取0.1mL溶液b,加水稀释至1.0mL,得溶液c;
④取0.4mL溶液c,加水稀释至1.0mL,得溶液d。
由于在整个配制过程中药液很稀,其密度都可近似看做1g/cm 3.则最终得到的药液(溶液d)中溶质的质量分数为 。
如图是实验室制取气体的有关装置图,据图回答下列问题:

(1)写出图中标号仪器的名称:X ,Y 。
22,应选用的发生装置为 (填装置序号,下同),收集装置为 2,则反应的化学方程式为 。
(3)小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气。
①若用F装置收集氧气,氧气应从 (填“a”或“b”)端通入。
②实验中发现不能得到平稳的氧气流。小涛同学提出可以从两个方面加以改进:
一是将制取的装置B换为上图中的装置 ;
二是将过氧化氢溶液加水稀释。如果把50g溶质质量分数为15%的过氧化氢溶液稀释成溶质质量分数为10%的溶液,需加水的质量为 克。
实验技能是学习化学和进行探究活动的基础和保证。
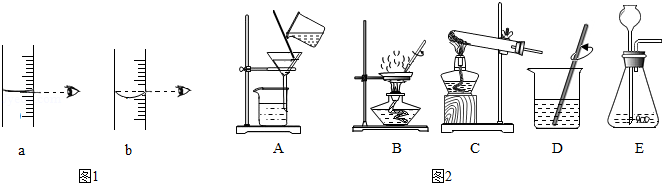
(1)实验室配制50g质量分数为6%的NaCl溶液,用到的玻璃仪器除试剂瓶、量筒、胶头滴管外,还需要 。量取读数时,如图视线角度正确的是 (填序号)。
(2)请根据如图装置或操作回答相关问题。
①选取图2中的序号,表示粗盐提纯的正确操作顺序为 。操作B的名称是 ,该操作中当 时,应停止加热。
②实验室用高锰酸钾固体制取氧气时,可选用的发生装置是 (填序号)。
某同学欲配制一定溶质质量分数的NaCl溶液,他准备了下列实验仪器。
请填空:
(1)配制时可按下列实验步骤进行:
计算→称量→量取→ 。
(2)称量时,NaCl固体粉末应放在托盘天平 (填"左盘"或"右盘")的纸片上。
(3)配制过程中为促进NaCl的溶解,还需要的一种玻璃仪器是 (填仪器名称)。
(4)量取一定体积的水,除了用量筒外,还需要用 (填仪器名称)。

实验室配制饱和澄清石灰水和质量分数为10%的氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 |
Ca(OH)2 |
NaOH |
CaCO3 |
Ca(HCO3)2 |
Na2CO3 |
NaHCO3 |
溶解度/g |
0.16 |
109 |
0.0065 |
16.6 |
21.8 |
9.6 |
(1)配制溶液。其中配制100g 10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体﹣量取水﹣溶解﹣装瓶﹣贴标签。
①称取氢氧化钠固体的质量 g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,画出水的液面。
③装瓶后贴标签,在标签上填写: 。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是 。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是 。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为 g,或需10%氢氧化钠溶液的质量至少为 g.(计算结果精确到个位)

在农业生产上,常用质量分数为16%的氯化钠溶液选种。现要配制该氯化钠溶液100kg,需要氯化钠固体和水的质量各是多少?
学习了酸、碱、盐有关知识后,小明在实验室称量氢氧化钠固体,配制了溶质质量分数为10%的氢氧化钠溶液,进行以下探究:

(1)若图Ⅰ中游码标尺读数为1.8,则他称取的氢氧化钠质量是 g.
(2)图Ⅱ中反应的化学方程式是 .
(3)图Ⅲ中玻璃棒的作用是 ,当出现较多固体时,应 .
(1)要配制50g溶质质量分数为11%的氯化钠溶液,需要水的体积为 mL(水的密度是1g•mL﹣1);
(2)下列配制氯化钠溶液的过程图组顺序有误且不全,请将⑦框内所缺的实验步骤图用文字补全在横线上 ;

(3)小明同学按(1)和(2)的正确实验步骤配制好溶液后,发现所配制的氯化钠溶液溶质的质量分数小于11%,造成溶质质量分数偏小的原因可能是 (填序号).
A.称量时药品和砝码放反了 B.量取水时仰视量筒读数
C.所取用的氯化钠含有杂质 D.称量好的溶质倒入烧杯时有部分洒出
(4)金属与酸反应的剧烈程度反映了金属活动性的强弱.把形状、大小相同的纯金属
A、B、C、D同时放入装有足量稀盐酸的烧杯中,以下卡通图形象地表现了此实验现象,由图2可知,活动性最强的金属是 (填字母代号).
(5)请你写出锌与稀盐酸反应的化学方程式: .
(6)图3所示,将一支充满二氧化碳气体的试管倒插入氢氧化钠溶液中,一段时间后试管内液面上升了,请用化学方程式表示所发生的化学反应为: .
