化学与生活密切相关,下列说法正确的是( )
| A. |
苯甲酸钠可作为食品防腐剂是由于其具有酸性 |
| B. |
豆浆能产生丁达尔效应是由于胶体粒子对光线的散射 |
| C. |
SO2可用于丝织品漂白是由于其能氧化丝织品中有色成分 |
| D. |
维生素C可用作水果罐头的抗氧化剂是由于其难以被氧化 |
我国科学家发现一种钒配合物Ⅰ可以充当固氮反应的催化剂,反应过程中经历的中间体包括Ⅱ和Ⅲ。
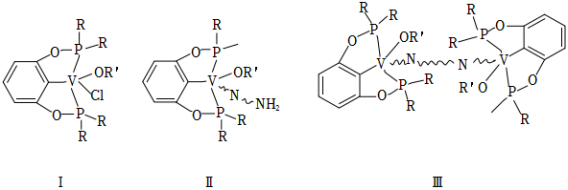
(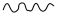 代表单键、双键或三键)
代表单键、双键或三键)
回答问题:
(1)配合物Ⅰ中钒的配位原子有 种,它们是_____。
(2)配合物Ⅰ中, 代表芳基, 空间结构呈角形,原因是__________。
(3)配合物Ⅱ中,第一电离能最大的配位原子是_____。
(4)配合物Ⅱ和Ⅲ中,钒的化合价分别为 和 ,配合物Ⅱ、Ⅲ和 三者中,两个氮原子间键长最长的是_____。
(5)近年来,研究人员发现含钒的锑化物 在超导方面表现出潜在的应用前景。 晶胞如图1所示,晶体中包含由 和 组成的二维平面(见图2)。
①晶胞中有 个面的面心由钒原子占据,这些钒原子各自周围紧邻的锑原子数为_____。锑和磷同族,锑原子基态的价层电子排布式为_____。
②晶体中少部分钒原子被其它元素(包括 )原子取代,可得到改性材料。下列有关替代原子说法正确的是_____。
| A. |
有 或 价态形式 |
| B. |
均属于第四周期元素 |
| C. |
均属于过渡元素 |
| D. |
替代原子与原离子的离子半径相近 |
局部麻醉药福莫卡因的一种合成路线如图:
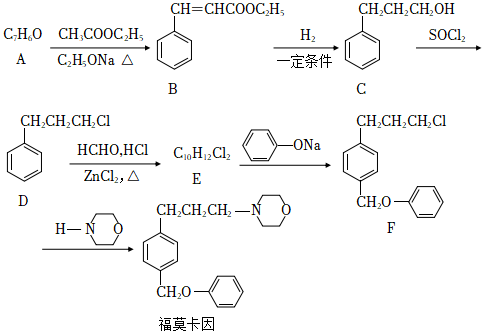
回答问题:
(1)A的结构简式:_____,其化学名称_____。
(2)B中所有官能团名称:__________。
(3)B存在顺反异构现象,较稳定异构体的构型为_____式(填“顺”或“反”)。
(4)B→C的反应类型为_____。
(5)与E互为同分异构体之——X,满足条件①含有苯环②核磁共振氢谱只有1组吸收峰,则X的简式为:_____(任写一种)。
(6)E→F的反应方程式为__________。
(7)结合上图合成路线的相关信息。以苯甲醛和一两个碳的有机物为原料,设计__________。
某小组开展“木耳中铁元素的检测”活动。检测方案的主要步骤有:粉碎、称量、灰化、氧化、稀释、过滤、滴定等。回答问题:
(1)实验方案中出现的图标 和
和 ,前者提示实验中会用到温度较高的设备,后者要求实验者_____(填防护措施)。
,前者提示实验中会用到温度较高的设备,后者要求实验者_____(填防护措施)。
(2)灰化:干燥样品应装入_____中(填标号),置高温炉内,控制炉温 ,在充足空气氛中燃烧成灰渣。
| A. |
不锈钢培养皿 |
| B. |
玻璃烧杯 |
| C. |
石英坩埚 |
(3)向灰渣中滴加 的硝酸,直至没有气泡产生。灰化容器中出现的红棕色气体主要成分是_____(填化学式),因而本实验应在实验室的_____中进行(填设施名称)。
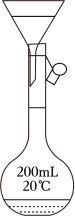
若将漏斗直接置于容量瓶上过滤收集滤液(如图所示),存在安全风险,原因是__________。
(4)测定铁含量基本流程:将滤液在 容量瓶中定容,移取 ,驱尽 并将 全部还原为 。用 微量滴定管盛装 标准溶液进行滴定。
①选用微量滴定管的原因是__________。
②三次平行测定的数据如表。针对该滴定数据,应采取的措施是_____。
|
序号 |
1 |
2 |
3 |
|
标准溶液用量/ |
|
|
|
③本实验中,使测定结果偏小的是_____(填标号)。
| A. |
样品未完全干燥 |
| B. |
微量滴定管未用标准溶液润洗 |
| C. |
灰渣中有少量炭黑 |
磷酸二氢钾在工农业生产及国防工业等领域都有广泛的应用。某研究小组用质量分数为 的磷酸与 反应制备 ,反应方程式为 一定条件下的实验结果如图1所示。

回答问题:
(1)该条件下,反应至 时 的转化率为_____。
(2)该制备反应的ΔH随温度变化关系如图2所示。该条件下反应为_____反应(填“吸热”或“放热”),且反应热随温度升高而_____。
(3)该小组为提高转化率采用的措施中有:使用浓磷酸作反应物、向系统中不断通入水蒸气等。它们能提高转化率的原因是:不使用稀磷酸__________;通入水蒸气__________。
(4) 时, 的平衡常数 _____。(已知 的 )
铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为( ,还含有一定量的 和 )生产 的一种工艺流程如图。
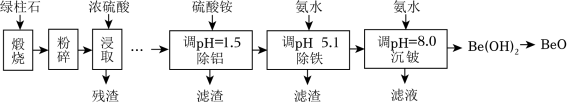
回答问题:
(1) 中 的化合价为_____。
(2)粉碎的目的是__________;残渣主要成分是_____(填化学式)。
(3)该流程中能循环使用的物质是_____(填化学式)。
(4)无水 可用作聚合反应的催化剂。 与足量 在 制备 的化学方程式为__________。
(5)沉铍时,将 从 提高到 ,则铍的损失降低至原来的_____ 。
(多选) 下, 水溶液的 随其浓度的变化关系如图所示。下列说法正确的是( )
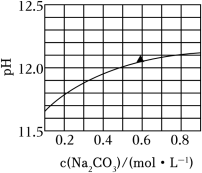
| A. |
时,溶液中 |
| B. |
水解程度随其浓度增大而减小 |
| C. |
在水中 的 |
| D. |
的 溶液和 的 溶液等体积混合,得到的溶液 |
(多选)工业上苯乙烯的生产主要采用乙苯脱氢工艺: 。某条件下无催化剂存在时,该反应的正、逆反应速率 随时间 的变化关系如图所示。下列说法正确的是( )
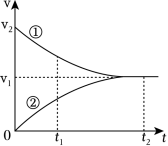
| A. |
曲线①表示的是逆反应的 关系 |
| B. |
时刻体系处于平衡状态 |
| C. |
反应进行到 时, ( 为浓度商) |
| D. |
催化剂存在时, 都增大 |
闭花耳草是海南传统药材,具有消炎功效。车叶草苷酸是其活性成分之一,结构简式如图所示。下列有关车叶草苷酸说法正确的是( )

| A. |
分子中含有平面环状结构 |
| B. |
分子中含有 个手性碳原子 |
| C. |
其钠盐在水中的溶解度小于在甲苯中的溶解度 |
| D. |
其在弱碱介质中可与某些过渡金属离子形成配合物 |
下列实验操作不能达到实验的是( )
|
选项 |
A |
B |
C |
D |
|
目的 |
检验 氯丁烷中氯元素 |
检验 是否沉淀完全 |
制备检验醛基用的 |
制备晶体 |
|
操作 |
|
|
|
|
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
(多选)近年来,我国航天科技事业取得了辉煌的成就。下列说法错误的是( )
| A. |
我国科学家由嫦娥五号带回的月壤样品中,首次发现了天然玻璃纤维,该纤维中的主要氧化物 属于离子晶体 |
| B. |
某型长征运载火箭以液氧和煤油为推进剂,液氧分子间靠范德华力凝聚在一起 |
| C. |
“嫦娥石” 是我国科学家首次在月壤中发现的新型静态矿物,该矿物中的 位于周期表中的 区 |
| D. |
航天员出舱服中应用了碳纤维增强复合材料。碳纤维中碳原子杂化轨道类型是 |
(多选)实践中一些反应器内壁的污垢,可选用针对性的试剂溶解除去。下表中污垢处理试剂的选用,符合安全环保理念的是( )
|
选项 |
A |
B |
C |
D |
|
污垢 |
银镜反应的银垢 |
石化设备内的硫垢 |
锅炉内的石膏垢 |
制氧的 垢 |
|
试剂 |
溶液 |
溶液; 溶液 |
饱和 溶液; 柠檬酸溶液 |
浓 溶液 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
利用金属 、海水及其中的溶解氧可组成电池,如图所示。下列说法正确的是( )
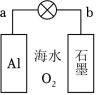
| A. |
电极为电池正极 |
| B. |
电池工作时,海水中的 向 电极移动 |
| C. |
电池工作时,紧邻 电极区域的海水呈强碱性 |
| D. |
每消耗 ,电池最多向外提供 电子的电量 |
各相关物质的燃烧热数据如表。下列热化学方程式正确的是( )
|
物质 |
|
|
|
|
|
|
|
|
| A. |
|
| B. |
|
| C. |
|
| D. |
|