已知:
以乙炔为原料,通过下图所示步骤能合成有机中间体E(转化过程中的反应条件及部分产物已略去)。
其中,A,B,C,D分别代表一种有机物,B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1)A生成B的化学反应类型是____________________________。
(2)写出生成A的化学反应方程式_________________________________________。
(3)B在浓硫酸催化下加热,可生成多种有机产物。写出2种相对分子质量比A小的有机产物的结构简式:_________________、__________________。
(4)写出C生成D的化学反应方程式:
__________________________________________________________________。
(5)含有苯环,且与E互为同分异构体的酯有______种,写出其中一种同分异构体的结构简式:___________________________________________________________。
下图中A-J均为有机化合物,根据图中的信息,回答下列问题:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.20%。B的一氯代物仅有一种,B的结构简式为______;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为______;
(3)由A生成D的反应类型是______,由D生成E的反应类型是______;
(4)G的分子式为C6H10O4,0.146 g G需用20 mL 0.100 mol·L-1 NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为______;
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应:
则由E和A反应生成F的化学方程式为______;
(6)H中含有的官能团是______,I中含有的官能团是______。
(7分)某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。
请回答下列问题:(1)根据上述框图信息填写下表(不能确定的不填):
| |
肯定存在的离子 |
肯定没有的离子 |
| 化学式或离子符号 |
|
|
(2)写出沉淀A三种可能的情况:______________________________,若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为 。
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是_____________________。
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D同主族;C与E同主族;B、C同周期;B原子最外层电子数比其次外层电子数多2;B、A两元素的核电荷数之差等于它们的原子最外层电子数之和;F元素是同周期元素中原子半径最小的主族元素。A、B、C、D、E、F形成的化合物甲、乙、丙、丁、戊、己的组成如下表所示。
| 化合物 |
甲 |
乙 |
丙 |
丁 |
戊 |
己 |
| 化学式 |
A2C |
A2C2 |
B2A2 |
D2C2 |
A2E |
DF |
回答下列问题
(1)元素B的元素符号是: 化合物丙的电子式为 。化合物丁存在的化学键类型是 。
(2)化合物甲的沸点比戊 (填“高”或“低”),B、C、D原子半径从大到小依次为 (用元素符号)
(3)向含有0.2 mol乙的水溶液中加入少量MnO2,使乙完全反应,发生转移的电子数为 NA (NA代表阿伏加德罗常数)
(4)A单质与C单质在KOH溶液中可以组成燃料电池,则正极附近溶液的pH将 ;放电一段时间KOH的物质的量 (填“变大”“变小”“不变”)
(5)用电子式表示己的形成过程: 。
(12分) A、B、C、D是由短周期元素形成的单质。B、E均为组成空气的成分。化合物F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)E的结构式 ,F的电子式 。
(2)A元素的一种核素用于考古,写出该核素符号________________。
(3)F与水反应的化学方程式是____________________________________________。
(4)F与G的水溶液反应生成I和D的离子方程式是________________________________。
(5)1.7g D的气态氢化物完全燃烧放热6.8kJ,写出表示该气态氢化物燃烧热的热化学方程式_____。
已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
请回答下列问题:
(1)组成B单质的元素在周期表中的位置是_________________________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是________________________________。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:___________________________。
(4)写出D与足量的N反应生成E和F的化学方程式:_________________________________。
(5)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有_______个。
 是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔(
是对甲基苯乙醛的键线式,由它转化为对甲基苯乙炔( )的一条路线如下:
)的一条路线如下:
(1)对甲基苯乙醛的分子式为: ;
(2) 分子中一定在同一平面的原子数为 个;
分子中一定在同一平面的原子数为 个; 分子中在同一直线上的原子数最多有 个;
分子中在同一直线上的原子数最多有 个;
(3)写出①--④步反应所加试剂、反应条件和①--③步反应类型:
| 序号 |
所加试剂及反应条件 |
反应类型 |
| ① |
|
|
| ② |
|
|
| ③ |
|
|
| ④ |
|
|
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大。甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍。在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
试回答:
(1)A的电子式为 ;所含化学键类型为 ;A晶体的晶胞中阳离子和阴离子的个数比为 。
(2)溴元素在周期表的位置 丁元素的阴离子结构示意图为 。
(3)甲、乙、丙、丁四元素的离子半径由大到小的顺序为(用离子符号表示) ;甲、乙、丙、丁四元素的第一电离能由大到小的顺序为(用元素符号表示) 。
(4)F分子的空间构型为 ;H分子的空间构型为 ;
(18 分)(Ⅰ) 将某红棕色气体 A 通入到稀钠盐溶液甲中,有白色沉淀产生;当红棕色气体通入过量时,白色沉淀逐渐完全消失。上述过程中还产生一种无色气体B,B 遇空气后又可产生 A。则:
(1)写出钠离子的结构示意图 ; B 与空气反应的化学方程式 。
(2)甲中肯定不含有下列物质中的 ;(填选项字母)。
A.Na2S B.NaAlO2 C.Na2SiO3 D.NaCl
(3)通入气体 A 使白色沉淀逐渐消失且产生气体 B,该反应的离子方程式是 。
(Ⅱ)某研究小组为了探究一种无机化合物X(化合物 X 中带有 6 个结晶水,仅含五种元素,且每种元素在该化合物中均只有单一价态,X 的式量为400)的组成和性质,设计了如下实验:
(注明:以上气体体积均在标准状况下测定,产物中只有水未标出)
(1)写出气体B 的电子式 ,气体 D 的结构式 。
(2)混合气体 C 通入品红溶液褪色,加热后恢复原色的原因是 。
(3)8.00 固体 X 所含阴离子的物质的量是 mol。
(4)固体X 受热分解的化学方程式是 。
(10 分)有机物 G 是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成有机物 G。
已知:1. 
2. 
请回答下列问题:
(1)葡萄糖的分子式是 ,写出 G 中所含含氧官能团的名称 。
(2)由 A 转化为 B 的化学方程式为 。
(3)已知 D 的分子式为 C7H6O3,则 D 的结构简式为 。
(4)在上述转化过程中,属于取代反应的有 (填选项序号)。
①葡萄糖→A ②D→E ③B→C ④E + CH3COCl→ F
(5)写出 F 与足量的氢氧化钠反应生成的有机物的结构简式 。
[化学——选修5有机化学基础]异戊二烯是一种化工原料,有如下转化关系:

回答下列问题:
(1)A的名称(系统命名)是_________;B→C的反应类型是_________。
(2)B的结构简式是_________;D的核磁共振氢谱共有_________组峰。
(3)上述转化关系中互为同系物的是_________(填化合物代号)。
(4)F生成PHB的化学方程式是_________。
(5)E的同分异构体中,既能发生银镜反应,也能与碳酸氢钠溶液反应的共有_________种
(不考虑立体异构)。
(6)F除了合成PHB外,还可经过_________、酯化、聚合三步反应合成 (一种类似有机玻璃的塑料)。在催化剂作用下,第三步反应的化学方程式是__________________
(一种类似有机玻璃的塑料)。在催化剂作用下,第三步反应的化学方程式是__________________
A、B、C为为中学常见单质。通常状况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
请回答下列问题:
(1)写出下列物质的化学式:A______、X______。
(2)在反应;①~⑦中,属于氧化还原反应的有____个;反应⑥说明D溶液中含有___离子。
(3)反应④的离子方程式是__________。
(4)反应⑦的化学方程式是__________。
(5)检验D的溶液中是否含有G阳离子的方法是_________。
(6)除去D溶液中混有的少量G的方法是_____________。
“心得安”是治疗心脏病的药物,下面是它的一种合成路线具体反应条件和部分试剂略)。
回答下列问题:
(1)试剂b的结构简式为_______________,b中官能团的名称__________________。
(2)③的反应类型是________________。
(3)心得安的分子式为_________________。
(4)试剂b可由丙烷经三步反应合成: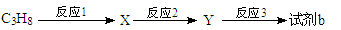
反应1的试剂与条件为________________。反应3的反应类型是_________________。
X的核磁共振氢谱显示其分子中含有2种氢原子,反应2的化学方程式为:_______________________。若一次取样,检验X中所含官能团,按使用的先后顺序写出所用试剂:___________________________。
(5)芳香化合物D是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成EC2H4O(2)和芳香化合物FC8H6O4,E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。
D的结构简式为____________________;由F生成一硝化产物的化学方程式为:_____________________,芳香化合物F的名称是________________________________。
以乙炔或苯为原料可合成有机酸H2MA,并进一步合成高分子化合物PMLA。
I.用乙炔等合成烃C。
已知:
(1)A分子中的官能团名称是 、
(2)A的结构简式是
A的一种同分异构体属于乙酸酯,其结构简式是 。
(3)B转化为C的化学方程式是 ;
其反应类型是 反应。
II.用烃C或苯合成PMLA的路线如下。
已知:
(4)1 mol有机物H与足量NaHCO3溶液反应生成标准状况下的CO2 44.8 L,H有顺反异构,其反式结构简式是
(5)E的结构简式是
(6)G与NaOH溶液在加热条件下反应的化学方程式是
(7)H的核磁共振氢谱呈现 个吸收峰。
(8)聚酯PMLA有多种结构,写出由H2MA制PMLA的化学方程式(任写一种)
________________________________________________________
H是一种新型香科的主要成分之一,其结构中含有三个六元环. H的合成路线如下(部分产物和部分反应条件路去):
己知:①B中核磁共振里谱图显示分子中有6种不同环境的氢原子。
③D和G是同系物
请回答下列问题:
(1)用系统命名法命名(CH3)2C=CH2 。
(2)A→B反应过程中涉及的反应类型有 。
(3)写出D分子中含有的官能团名称: 。
(4)写出F与足量氢氧化钠溶液在加热条件下反应的化学方程式: 。
(5)写出E在铜催化下与O2反应生成物的结构简式: 。
(6)同时满足下列条件:①与FeCl3溶液发生显色反应;②能发生水解反应;③苯环上有两个取代基的G的同分异构体有 种(不包括立体异构)其中核磁共振氢谱为5组峰的为 (写结构简式)。