2012年11月某白酒企业生产的白酒被曝塑化剂超标267%,白酒产品中的塑化剂主要源于塑料接酒桶、塑料输酒管、成品酒塑料内盖等。塑化剂DEHP的合成线路如下:
(1)A用系统命名法命名为______________,C分子核磁共振谱中显示有__________种不同化学环境的氢原子。C在一定条件下与乙二醇反应生成的高聚物是一种重要的合成纤维,俗称涤纶,其结构简式是__________。
(2)B含有的官能团名称为__________,①、②的反应类型分别为_______、_______。
(3)写出满足下列条件的C的同分异构体的结构简式:____________。
a.是苯的邻位二元取代物;b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应
(4)写出下列反应的化学方程式:
反应②:_______________________________________________;
反应④:_______________________________________________。
氧氮杂环是新药研制过程中发现的一类重要活性物质,具有抗惊厥、抗肿瘤、改善脑缺血等性质。下面是某研究小组提出的一种氧氮杂环类化合物H的合成路线:
(1)原料A的同分异构体中,含有苯环、且核磁共振氢谱中有4个峰的是______(写出其结构简式)。
(2)③的反应类型是______。原料D中含有的官能团名称是______、______。
(3)反应②的化学方程式是______________________________。
(4)原料B俗名“马来酐”,它是每来酸(顺丁烯二酸: )的酸酐,它可以经下列变化分别得到苹果酸(
)的酸酐,它可以经下列变化分别得到苹果酸( )和聚合物Q:
)和聚合物Q:
①半方酸是原料B的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含 -O-O-键。半方酸的结构简式是____________。
②写出反应I和反应II的化学方程式_____________、____________。
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1 : 1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为______。
(2)B、C、D三种元素的第一电离能由小到大的顺序为______。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为______
(4)下列叙述正确的是______(填序号)。
a. M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键 d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5) 已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g) △H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:__________________________
(6)在0.5 L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g) +3 A2(g)=2CA3(g) △H<0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
①试比较K1,K2的大小,K1________K2(填写“ >”、“=”或“<”)。
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1 mol、2 mol时,则该反应的 V(C2)正_________(C2)逆(填写“>”、“=”或“<”)。
已知:I.质谱分析测得有机化合物A的相对分子质量为92.5,含有碳、氢、氯三种元素,且 氢的质量分数为9.73%0
Ⅱ.A有如下的转化关系
III.与羟基相连的碳上没有氢原子的醇(结构: )不能氧化成醛或酮。
)不能氧化成醛或酮。
Ⅳ.F的核磁共振氢谱有两种吸收峰,其峰面积之比为9:1.
V.E和G都能和新制的Cu(OH)2悬浊液反应,但反应类型不同,H是一种具有果香味的液体。
根据以上信息回答下列问题
(1)A的分子式为 ,A的结构简式为 。
(2)E的官能团为 (写化学式),反应⑦的反应类型为 。
(3)D还有两种相同类别的同分异构体在Ⅱ中没有出现,它们的结构简式分别为 和 。
(4)在B的同分异构体中存在顺反异构现象,请写出其反式异构体的结构简式并命名:
、 。
(5)写出下列反应的化学方程式:
反应⑤ 。
反应⑧ 。
(6)若M的分子式为C4H2Cl8,若不考虑立体异构,其同分异构体有 种。
W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大。W原子核外有2个未成对电子,Q是电负性最大的元素,R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍。请回答下列问题(答题时,W、Y、Z、Q、R用所对应的元素符号表示):
(l)W、Y、Z 三种元素的第一电离能由大到小的顺序为 。在上述三种元素的原子中,写出与WZ2互为等电子体的分子式 。
(2)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键)
该分子中Y原子的杂化方式是 杂化。
(3)W2-2阴离子的电子式为 ,Z原子最外层电子排布式为 。
(4)YQ3分子的空间构型为 ,Y和Q两元素的氢化物的沸点相比较,高者是 (写分子式).往硫酸铜溶液中通入过量的YH3(Y的氢化物分子式),可生成配离子[Cu(YH3)4]2+,但YQ3不易与Cu2+形成配离子,其原因是 。
(5)科学家通过X射线探明RZ的晶体结构与NaCl晶体结构相似。那么在RZ晶体中距离R2+最近且等距离的R2+有 个。若在RZ晶体中阴阳离子间最近距离为a cm,晶体密度为ρg/cm3,则阿伏伽德罗常数NA的表达式为 mol-1。
(6)已知非整数比化合物R0.95Z,其晶体结构与NaCI相似,但由于R、Z离子个数比小于1:1,故晶体存在缺陷。R0.95Z可表示为( )
下图中A、B、C、D、E均为有机化合物。已知:C能与NaHCO3溶液发生反应,C
和D的相对分子质量相等,且D催化氧化的产物不能发生银镜反应。
回答下列问题:
(1)C分子中官能团的名称是__________;化合物B不能发生的反应是_________。(填字母序号) a.加成反应b.水解反应c.消去反应d.酯化反应
(2)写出E的结构简式______________________________________。
(3)写出反应①的化学方程式:_____________________________________________。
(4)同时符合下列三个条件的B的同分异构体有多种:
a.苯环上有二个取代基且苯环上的一氯代物有2种
b.能与FeCl3溶液发生显色反应
c.能发生水解反应
试写出lmol B的同分异构体中,能与3molNaOH反应的结构简式_______________。
下列是利用烃C3H6合成有机高分子E和C6H14的流程图,请回答以下问题:
(1)①〜⑥中属于取代反应的有_______________;
(2)C6H14核磁共振谱只有两种峰,则C6H14的结构简式为:_________________,
写出E的结构简式:___________________;
(3)写出B与新制Cu(OH)2悬浊液反应的化学方程式:________________________;
(4)D的同分异构体很多,符合下列条件的同分异构体有___种,其中氢原子核磁共振谱谱峰最少的结构简式为_______。
①含碳碳双键 ②能水解 ③能发生银镜反应
(5)根据你所学知识和上图中相关信息,以乙醇为主要原料通过三步可能合成环己烷(无机试剂任选),写出第一步和第三步化学反应的化学方程式(有机物质写结构简式):
________________________________、________________________________________。
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 。
(2)已知:①E-E→2E·;△H=+a kJ·mol-1
② 2A·→A-A;△H=-b kJ·mol-1
③E·+A·→A-E;△H=-c kJ·mol-1(“·”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 |
甲 |
乙 |
丙 |
| 初始投料 |
2 molA2、1 molBC |
1 molX |
4 molA2、2 molBC |
| 平衡时n(X) |
0.5mol |
n2 |
n3 |
| 反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
放出Q3kJ |
| 体系的压强 |
P1 |
P2 |
P3 |
| 反应物的转化率 |
α1 |
α2 |
α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率v(A2) 。
②该温度下此反应的平衡常数K的值为 。
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=d C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
双酚A (也称BPA)常用来生产防碎塑料聚碳酸酯。BPA的结构简式如下图所示。
(1)双酚A中的含氧官能团为______(填名称)。
(2)下列关于双酚A的叙述中,不正确的是______(填标号)。
A.遇FeCl3溶液变色
B.可以发生还原反应
C.1mol双酚A最多可与2molBr2反应
D.可与NaOH溶液反应
(3)双酚A的一种合成路线如下图所示:
①丙烯→A的反应类型是____________。
②B→C的化学方程式是__________________。
③D的结构简式是____________。
(4)双酚A制取聚碳酸酯的过程中需要用到碳酸二甲酯( )。有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
)。有机物W是碳酸二甲酯的同分异构体,W具有如下特征:
i.只含l个甲基
ii.能分别与乙酸、乙醇发生酯化反应
写出W与乙酸反应的化学方程式:________________________。
某铵态氮肥由W、X、Y、Z等4种短周期元素组成,其中W的原子半径最小。
I.若Y、Z同主族,ZY2是形成酸雨的主要物质之一。
(1)将X、Y、Z的元素符号填在右图所示元素周期表(局部)中的相应位置上。
(2)X的最髙价氧化物对应水化物的稀溶液与铜反应的化学方程式为___ ___。
(3)一定条件下,1mol XW3气体与O2完全反应生成X元素的单质和液态水,放出382.8 kJ热量。该反应的热化学方程式为________________________。
II.若Z是形成化合物种类最多的元素。
(4)该氮肥的名称是______(填一种)。
(5)HR是含Z元素的一元酸。室温时,用0.250mol•L—1NaOH溶液滴定25.0 mL HR溶液时,溶液的pH变化情况如图所示。其中,a点表示两种物质恰好完全反应。
①右图中x______7(填“>”、“<”或“=”)。
②室温时,HR的电离常数Ka=______(填数值)。
某有机物G分子结构的球棍模型如下图所示(图中小球分别表示碳、氢、氧原子,球与球之间的连线“一”不一定是单键)。用芳香烃A为原料合成G的路线如下:
试回答:
(1)G的分子式为_______;G中环状基团被氢原子取代后的有机物名称为_______。
(2)A的结构简式为______;D中官能团的名称为_______。
(3)B→C反应的化学方程式是____________________________;
E→F反应的化学方程式是____________________________。
(4)E的同分异构体中可用通式 表示(其中X、Y均不为H),且能发生银镜反应的物质有_______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可) ________________。
表示(其中X、Y均不为H),且能发生银镜反应的物质有_______种,其中核磁共振氢谱有6个峰的物质结构简式为 (写出一种即可) ________________。
I.物质A为生活中常见的有机物,只含有C、H、O三种元素,已知该有机物的蒸气密度是相同条件下H2密度的23倍,其中氧元素的质量分数为34.8%,且有如下的转化关系:
(1)由A→B的反应类型是 。
(2)D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键,反应①中D与HCl按物质的量之比1:l反应,原子利用率为100%,则D的结构简式是 。
II.化合物E和F是药品普鲁卡因合成的重要原料。普鲁卡因的合成路线如下:
(3)由甲苯生成物质甲的化学方程式为 。
(4)丁的结构简式为 。
(5)反应③的化学方程式是 。
(6)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式。符合下列条件的戊的同分异构体有 种(包含戊)。
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构.中一定含官能团—NH2,且—NH2直接与碳原子相连
戊经聚合反应可制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是 。
物质A、B、C、D、E、F、G、H、I、J有如图所示的转化关系。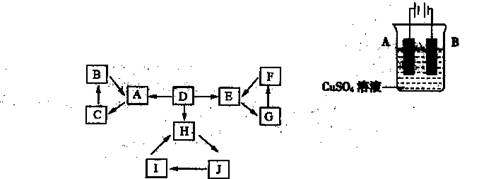
图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素。其它信息见下表:
| 编号 |
信 息 |
| 1 |
D为地壳中含量最高的元素组成的单质 |
| 2 |
E为酸性气态氧化物 |
| 3 |
F的浓溶液常做干燥剂 |
| 4 |
H为淡黄色固体化合物 |
| 5 |
电解饱和J溶液是工业重要反应 |
| 6 |
C为离子化合物,阴、阳离子均含有金属元素 |
(1)写出G的化学式: ,指出H中化学键的类型: 。
(2)常温下测得一定浓度的C溶液的pH=10,用离子方程式表示其原因 。
(3)写出与H相对分子质量相同,且它们的阴离子所含的电子数、电荷数也均相同的化合物的化学式 。
(4)写出C溶液中通入过量CO2的化学方程式: 。 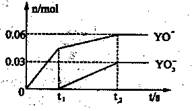
(5)通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中三种含Y元素的离子,其中两种离子物质的量(n)与反应时间(t)的变化示意图如上图所示,写出该反应的离子方程式是 ,该苛性钾溶液中KOH的质量是 g。
用作软质隐形眼镜材料的聚合物E是:
一种合成聚合物E的路线如下:
回答下列问题:
(1)A能与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A的结构简式是 ;
(2)D中含有的官能团名称为 ;
(3)D→E的反应类型是 反应;
(4)C有多种同分异构体。属于酯且含有碳碳双键的同分异构体共有 种(不考虑顺反异构),写出其中核磁共振氢谱峰面积之比为1:1:1:3的同分异构体的结构简式 ;
(5)写出由乙烯合成乙二醇的化学方程式。 。
某蓝色荧光材料F的合成路线如下:
(1)化合物B中含有的含氧官能团的名称是 。
(2)写出化合物CH3NCS的结构式: 。
(3)合成路线中属于加成反应的反应有 。(填序号)
(4)反应③另一产物为甲醇,其化学方程式为 。
(5)与A具有相同的含氮六元环和官能团的同分异构体共有 种(包含本身。已知含氮六元环与苯环结构相似)。
(6)已知: 。请写出以
。请写出以 和甲醇为主要原料制备
和甲醇为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH  CH2=CH2
CH2=CH2 BrCH2—CH2Br
BrCH2—CH2Br