[陕西]2013届陕西省宝鸡市高三第三次模拟理综化学试卷
下列有关含氯化合物的说法正确的是
| A.HCIO是弱酸,所以NaC1O是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.工业上电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移阿伏加德罗常数个电子NA |
下列除杂方法合理的是
| A.C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱石灰干燥 |
| B.CaCO3中混有的少量NaHCO3,可以用加热的方法除去 |
| C.乙烯中混有的SO2气体,可以通过酸性高锰酸钾溶液除去 |
| D.H2S中混有的水蒸气,可以用浓硫酸除去 |
下列关于常见有机化合物的说法正确的是
| A.乙烯和聚乙烯都能与溴的四氯化碳溶液发生加成反应 |
| B.乙醇和苯都不能使溴的四氯化碳溶液和酸性KMnO4溶液褪色 |
| C.乙醇、乙酸、乙酸乙酯都能发生取代反应 |
| D.糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物 |
下列对实验现象的预测不正确的是
| A.向氢氧化铁胶体中滴加盐酸至过量,先有沉淀出现,后沉淀溶解 |
| B.向Ca(ClO)2溶液中通人CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
| C.向CaCl2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
| D.向Ca(OH)2溶液中通入SO2,溶液变浑浊,继续通SO2至过量,浑浊消失 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3一kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是
A.C(s)+ O2(g)=CO(g);△H=" -" 393.5 kJ/mol O2(g)=CO(g);△H=" -" 393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l);△H="+571.6" kJ/mol |
| C.CH4(g)+CO2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H="-1400" kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H="-1400" kJ/mol |
25℃时,CaCO3在水中的溶解平衡曲线如同所示。已知25℃时,CaCO3的Ksp=2.8×10-9。据图分析,下列说法不正确的是
| A.x的数值为2×10-5 |
| B.c点时有碳酸钙沉淀生成 |
| C.b点与d点对应的溶度积相等 |
| D.加入蒸馏水可使溶液由d点变到a点 |
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/L X和W形成化合物的水溶液pH为1。下列说法正确的是
| A.由于非金属性Y>R,所以X、Y组成化合物的沸点高于X、R组成的化合物 |
| B.Y和其他四种元素均可形成至少两种的二元化合物 |
| C.RY2能与Y、Z形成的一种化合物反应生成Y2 |
| D.Y、Z、W三种元素组成化合物的水溶液一定显碱性 |
用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题:
(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示:
①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
在中学化学中铁及其化合物应用广泛,用所学知识回答下列问题。
(1)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X。取少量X溶液两份,一份加入KSCN溶液时,溶液显红色;另一份中加入酸性KMnO4溶液时,KMnO4溶液紫色褪去。试分析:
①溶液X含有的金属阳离子应该是 。
②用化学方程式表示上述金属阳离子产生的原因 。
③酸性KMn04溶液紫色褪去的离子方程式为 。
(2)含铬化合物有毒,通常是将废水中+6价铬(如Cr2O2—7)用还原剂还原成Cr3+,再调节溶液pH使Cr3+转化为Cr(OH)3沉淀而除去。工业上有一种电解除Cr2O2—7的方法:将含K2Cr2O7的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。
试分析该电解除Cr2O2—7的方法中:
①阴极的电极反应式为 ;
②电解时加入氯化钠的作用是 ;
③该方法能除去Cr2O2—7的原理是 。
某研究性学习小组为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列三种不同实验方案进行探究,请根据他们的设计回答有关问题。
【探究一】实验方案: 。
。
问题讨论:(1)实验中发生反应的化学方程式是 。
(2)若实验中称取5.4g铝镁合金粉末样品,投入VmL2.0mol/L NaOH溶液中,充分反应。则NaOH溶液的体积V≥ mL。
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为 。
【探究二】实验方案:称量xg铝镁合金粉末,放在如图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:(4)欲计算Mg的质量分数,该实验中还需测定的数据是 。
(5)假设实验中测出该数据为yg,则原铝镁合金粉末中镁的质量分数为 (用含x、y代数式表示)。
[探究三]实验方案: 。
。
问题讨论:(6)同学们拟选用下边的实验装置完成实验,你认为最简易的装置其连接顺序是:
a接 。(填接口字母,仪器不一定全选。) 
(7)同学们仔细分析(6)中连接的实验装置后,又设计了下左图所示的实验装置。
①装置中导管a的作用是 。
②实验前后碱式滴定管中液面读数分别如上右图,则产生氢气的体积为 mL。
③与上左图装置相比,用(6)中连接的装置进行实验时,容易引起误差的原因是 (任写一点)。
下图是工业上生产碳酸锂的部分工艺流程,请根据流程图及已知信息回答问题。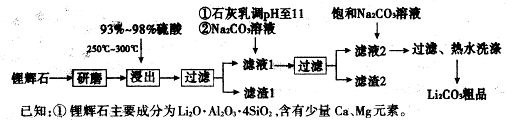
②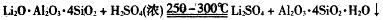
③几种物质不同温度下的溶解度。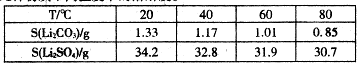
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。写出图中①、②、③表示的各物质,步骤II中反应的离子方程式是 。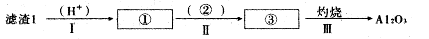
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:
。
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解。阳极的电极反应式是 。
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是 。
下表是元素周期表的一部分,其中A—G分别代表一种元素。 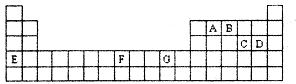
请根据表中所列元素,回答下列问题:
(1)所列元素中第一电离能最小的是 (填元素符号);D元素原子核外有 种不同运动状态的电子;基态原子的价电子层中,未成对电子数最多的元素是 (填元素符号)。
(2)AC2分子的空间构型是 ,该分子中A原子的杂化方式为 。
(3)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物的溶解度,原因是 。
(4)基态G2+的核外电子排布式是 ,乙二胺(结构简式为H2N—CH2一CH2—NH2)分子中的碳原子的杂化方式为 ,G2+与乙二胺可形成配离子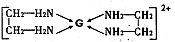 该配离子中含有的化学键类型有 (填字母编号)。
该配离子中含有的化学键类型有 (填字母编号)。
a.配位键 b.极性键 c.离子键 d.非极性键
(5)化合物EF[F(AB)6]是一种常见的蓝笆晶体,其中的AB—与B2为等电子体,则、AB—的电子式为 。下图为该蓝色晶体晶胞的 (E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。
(E+未画出),该蓝色晶体的一个晶胞中E+的个数为 个。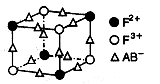
I.物质A为生活中常见的有机物,只含有C、H、O三种元素,已知该有机物的蒸气密度是相同条件下H2密度的23倍,其中氧元素的质量分数为34.8%,且有如下的转化关系:
(1)由A→B的反应类型是 。
(2)D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键,反应①中D与HCl按物质的量之比1:l反应,原子利用率为100%,则D的结构简式是 。
II.化合物E和F是药品普鲁卡因合成的重要原料。普鲁卡因的合成路线如下:
(3)由甲苯生成物质甲的化学方程式为 。
(4)丁的结构简式为 。
(5)反应③的化学方程式是 。
(6)普鲁卡因有两种水解产物戊和己,且戊与甲具有相同的分子式。符合下列条件的戊的同分异构体有 种(包含戊)。
a.分子结构中含苯环,且每个苯环有2个侧链
b.分子结构.中一定含官能团—NH2,且—NH2直接与碳原子相连
戊经聚合反应可制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号