利用下图所示实验(部分装置)收集氯气并验证氯气的性质:
(1)A为Cl2的发生装置。若制取氯气的化学方程式为________________,与之对应的A装置是__________(填写装置的序号)。
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改)。
(3)写出装置E中反应的离子方程式________________。
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝, ______________,然后伸入盛有氯气的集气瓶中。
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-,反应的离子方程式为__________。试设计实验方案,检验洗气瓶B溶液中Cl 和SO
和SO 的存在。可供选择的试剂及仪器为:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。
的存在。可供选择的试剂及仪器为:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。
海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:

①试剂Ⅰ适宜选用 (填序号)。
A.盐酸 B.石灰乳 C.氯化钠溶液
②操作Ⅰ的名称是 。
③工业上通过电解熔融的MgCl2制备金属Mg,该反应的化学方程式是 。
(2)下图是某课外小组在实验室模拟从海水中提取溴的实验装置。

A装置中通入Cl2一段时间后,改通热空气,将Br2吹出至B装置。
①A装置中发生反应生成Br2的离子方程式为 。
②B装置中,Br2被SO2还原,B装置中产生的两种主要阴离子的符号为 、 。
③C装置中NaOH溶液的作用是 。
能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。
(2)电能是现代社会应用最广泛的能源之一。
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是___________________,正极的电极反应式是______________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。
葡萄可用于酿酒。
(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是_______________________________________。
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的过程如下,补充完成下列化学方程式
C6H12O6(葡萄糖) 2________+2C2H5OH
2________+2C2H5OH
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备。实验室用下图所示装置制备乙酸乙酯:

①试管a中生成乙酸乙酯的化学方程式是________________________________。
②试管b中盛放的试剂是饱和_________________溶液。
⑧实验开始时,试管b中的导管不伸入液面下的原因是___________________。
④若分离出试管b中生成的乙酸乙酯,需要用到的仪器是____(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:(1)蒸馏;(2)水洗;(3)用干燥剂干燥;(4)用10%的NaOH溶液洗涤。正确的操作顺序是
| A.(1)(2)(3)(4) | B.(4)(2)(3)(1) |
| C.(4)(1)(2)(3) | D.(2)(4)(2)(3)(1) |
在实验室鉴定氯酸钾晶体和1氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水,过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。
(1)鉴定氯酸钾中氯元素的操作步骤是____________(填序号)。
(2)鉴定1氯丙烷中氯元素的操作步骤是____________(填序号)。
从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
| A.在灼烧过程中使用的仪器只有酒精灯、三脚架、泥三角、烧杯、玻璃棒 |
| B.在上述氧化过程中发生反应的离子方程式为2I-+H2O2=I2+2OH— |
| C.在提取碘单质时,用酒精作萃取剂 |
| D.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 |
下列实验中,不能达到预期目的的是
①用升华法分离碘和氯化铵的混合物
②用结晶法分离硝酸钾和氯化钠的混合物
③用分液法分离水和硝基苯的混合物
④用蒸馏法分离乙醇(沸点为78.5 ℃)和乙酸乙酯(沸点为77.5 ℃)的混合物
| A.①④ | B.②③ | C.③④ | D.②④ |
蒸馏是实验室制备蒸馏水的常用方法。下图是实验室制取蒸馏水的常用装置。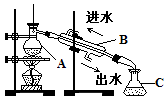
(1)图中明显的错误是 。
(2)仪器A的名称是 ,仪器B的名称是 。
(3)实验时,A中除加入适量自来水外,还需加入少量 ,其作用是 。
CuSO4溶液对过氧化氢的分解具有催化作用,有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究。
(1)请你帮助他们完成实验报告:
实验过程:在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:①
实验结论:FeCl3溶液可以催化分解H2O2
(2)以知FeCl3在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
甲同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的H2O;
乙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Fe3+;
丙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是② 同学的猜想,理由是③ 。
(3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表:
实验过程:向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管。
实验现象:无明显现象
结论④ 。
实验过程:向盛有5ml5%的H2O2溶液的试管中加入少量的⑤ ,并把带火星的木条伸入试管.
实验现象:⑥ 。
结论:⑦ 。
下列实验操作完全正确的是
| 编号 |
实 验 |
操 作 |
| A |
钠与水的反应 |
用镊子从煤油中取出金属钠,切下绿豆大小,放入装满水的烧杯中 |
| B |
配制一定浓度的氯化钾溶液500 mL |
准确称取氯化钾固体,放入到500 mL的容量瓶中,加水溶解、振荡、摇匀、定容 |
| C |
闻氯气的方法 |
用手轻轻地在瓶口扇动,使极少量氯气飘进鼻孔 |
 D D |
取出分液漏斗中所需的上层液体 |
下层液体从分液漏斗下端管口放出,关闭活塞,换一个烧杯,上层液体继续从分液漏斗下端管口放出 |
仅用下表提供的实验器材和药品,就能达到相应实验目的的是
| 编号 |
实验器材 |
实验药品 |
实验目的 |
| A |
托盘天平(带砝码)、100mL容量瓶、量筒、烧杯、药匙、玻玻棒 |
NaCl固体、蒸馏水 |
配制100 mL一定物质的量浓度的NaCl溶液 |
| B |
大试管、长颈漏斗、有孔塑料板、导管及橡皮塞、集气瓶、玻璃片、火柴 |
稀盐酸、块状石灰石 |
制取并收集二氧化碳气体 |
| C |
碱式滴定管、酸式滴定管、胶头滴管、铁架台(带铁夹)、锥形瓶 |
己知浓度的NaOH溶液、待测盐酸、蒸馏水、白纸 |
测定稀盐酸的物质的量浓度 |
| D |
铁架台(带铁夹)、酒精灯、大试管、集气瓶、导管及橡皮塞 |
氯化铵 |
制取并收集氨气 |
Ⅰ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液法 B、渗析 C、结晶法 D、分液法 E、蒸馏法 F、过滤法
(1)分离饱和食盐水和沙子的混合物
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)分离水和苯的混合物
(4)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶 。
Ⅱ.(1)指出下图装置中A、B的名称
A B
(2)分液操作中用到的主要仪器是 。
实验室要用98%(密度为1.84 g·cm-3)的硫酸配制3.68 mol/L的硫酸500 mL。
若配制3.68 mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是___。
| A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒 |
| B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外 |
| C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切 |
| D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切 |
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol·L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒? (填“能”或“否”)。
(3)他们记录的实验数据如下:已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18kJ·℃-1· kg-1,各物质的密度均为1g·cm-3。①计算完成下表。(保留小数点后一位)
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替HCl做实验,测定所得的中和热的数值将 (填“变大”或“变小”或“无影响”)。