三瓶遗失标签的无色溶液分别是盐酸、氢氧化钠、氢氧化钙,为鉴别这三瓶溶液进行如下实验。
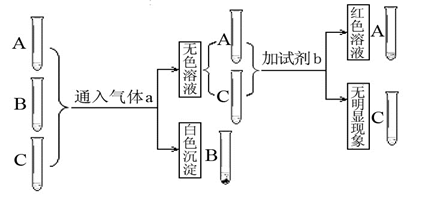
(1)①气体a的名称是 。
②生成白色沉淀的化学方程式是 。
③如果只用一种试剂来鉴别三种溶液,可选用的试剂是 。
(2)若遗失标签的是氢氧化钙、碳酸氢钠、盐酸三瓶溶液,鉴别时不需外加任何试剂,只需将其中的溶液①分别滴加到另外两种溶液②、③中,若实验现象是:一个有气泡,一个无明显现象,则①是___________。
实验小组研究碳酸钠和碳酸氢钠的性质。
实验一:甲、乙、丙三位同学分别用溶质质量分数为5%的NaHCO3溶液和Na2CO3溶液进行了如下实验。
| 实验内容 |
NaHCO3溶液 |
Na2CO3溶液 |
| (1)加入无色酚酞溶液 |
溶液变红 |
溶液变红 |
| (2)加入澄清石灰水 |
产生白色沉淀 |
现象Ⅰ |
| (3)加入5%的CaCl2溶液 |
产生白色沉淀、有气泡产生 |
产生白色沉淀 |
| (4)加入稀盐酸 |
现象Ⅱ |
有气泡产生 |
| (5)加热溶液,并用导管与澄清石灰水连接 |
石灰水变浑浊 |
石灰水无明显变化 |
(1)表中的现象Ⅰ为 ;用化学方程式表示现象Ⅱ的原因 。
(2)若要鉴别实验中用到的NaHCO3和Na2CO3两种溶液,实验一中提供了 种方法。
实验二:甲、乙、丙三位同学分别将各自实验一中NaHCO3溶液与澄清石灰水反应后的物质进行过滤,对滤液中的溶质成分进行了如下探究。
【查阅资料】
(1)氯化钙溶液显中性,与氢氧化钠溶液不反应。
(2)两种溶液的取用量不同,滤液中溶质的组成情况可能有:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH。
【进行实验】
| |
实验操作 |
实验现象 |
实验结论 |
| 甲同学 |
取少量滤液于试管中,滴加足量的稀盐酸 |
有气泡产生 |
滤液中的溶质一定含有Na2CO3 |
| 乙同学 |
取少量滤液于试管中,向其中通入少量CO2 |
产生白色沉淀 |
则滤液中的溶质是 |
| 丙同学 |
取少量滤液于试管中,塞紧胶塞,并用导管与澄清石灰水连接,加热 |
澄清石灰水变浑浊 |
则滤液中的溶质是Na2CO3和NaHCO3 |
【反思与评价】
(1)根据丙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是 。
(2)甲同学进一步实验,确定了滤液中的溶质是Na2CO3和NaOH。其实验方案是 。
甲同学探究NO2的氧化性;设计了如下实验装置:
(1)该装置的明显缺陷是:________________________。
(2)实验开始后,发现Zn溶解,但未发现有气体逸出,同学猜想可能是因为HNO3被还原生成NH4+
写出反应的离子方程式:__________________,如何验证该猜想:_______________。
(3)重新调整HNO3浓度后,发现A中有红棕色气体逸出,设计实验,证明NO2具有氧化性(药品任意选择,合理即可)
| 步骤 |
现象 |
结论 |
| 取少量C中反应后的溶液 置于试管中,__________ |
__________ |
NO2具有氧化性 |
(4)乙同学对甲的实验结果产生质疑,提出假设:
假设一:NO2氧化了SO32-
假设二:HNO3氧化了SO32-
问题1:假设二_____(“是”或“否”)合理,
理由:___________________(用化学方程式回答)
问题2:若要验证NO2具有氧化性,你的实验方案是:_____________________。
二氧化钛是一种重要的工业原料。
(1)实验室可通过以下方法制得:
TiCl4水解生成TiO2∙xH2O的化学方程式是_____;检验TiO2∙xH2O中Cl-是否被除净的方法是________。
(2)工业上可用含Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti化合价为+4价)制取,其主要流程如下:
Fe2O3与硫酸反应的离子方程式是________________;向甲溶液中加入铁的目的是________________。
(3)二氧化钛可用于制取金属钛,其步骤如下:
反应②的方程式是________________,该反应需要在 的气氛中进行,原因是________________。
的气氛中进行,原因是________________。
(每空2分,共10分)某同学学习过元素周期律、元素周期表后,为了探究同主族元素性质的递变规律,自己设计了一套实验方案,并记录了有关实验现象。现在请你帮助该同学完成实验报告。
Ⅰ.实验目的:探究同一主族元素性质的递变规律。
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳。
仪器:(1) ;(2) 。(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
| 序号 |
实验方案 |
实验现象 |
| ① |
将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 |
滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
| ② |
将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 |
滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
Ⅳ.实验结论:(3)_________________________________。
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4) 。
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱。试列举一项事实说明F的非金属性比Cl强:(5) 。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关的化学反应方程式为 ;
(2)装置B中饱和食盐水的作用是 ,同时装置B亦是安全瓶,可用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 ;
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是 (填编号);
| 编号 |
A |
B |
C |
D |
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ,事实上该现象并不能说明溴的非金属性强于碘,原因是 (用离子反应方程式解释);
(5)从原子结构角度解释氯、溴、碘的非金属性强弱递变规律及原因 ;
(6)装置F的目的是吸收余氯,试写出相应的离子反应方式 。
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,这两种仪器是① 。② 。
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略)。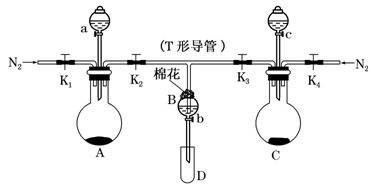
(1)按图连接好装置,检查装置的气密性后添加药品:向A装置的分液漏斗中加入浓盐酸,在圆底烧瓶中加入固体KMnO4;向B装置中加入10 mL FeCl2溶液,棉花浸润________溶液;在C装置的分液漏斗中加入70%的硫酸,向圆底烧瓶中加入固体Na2SO3。
(2)打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2。通入一段时间N2的目的是__________________。
(3)关闭K1,K3,K4,打开活塞a 和K2,逐滴加入浓盐酸,A装置中发生反应的方程式为___________。
(4)当B中溶液变为棕黄色时,停止滴加浓盐酸,夹紧K2,打开活塞b,使约2 mL的溶液流入D试管中,分别取1 mL溶液滴入_______(填试剂名称)和铁氰化钾溶液可以证明其中含有Fe3+和Fe2+。此时B中发生反应的离子方程式为____________。
(5)打开K3和活塞c,逐滴加入70%的硫酸,当B中溶液颜色逐渐变为_____色,停止滴加70%的硫酸,夹紧K3,打开活塞b,使约2 mL的溶液流入D试管中,并检验其中的离子。此时B中发生反应的离子方程式为______________。
(6)结合实验现象判断Fe3+、Cl2、SO2氧化性由强到弱的顺序为___________。
(13分)某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释。
(2)下列实验方案适用于在装置A中制取所需SO2的是 。
a.Na2SO3固体与浓硝酸 b.Na2SO3固体与浓硫酸
c.CaSO3固体与稀硫酸 d.碳与热的浓硫酸
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)往FeCl3溶液中通入足量SO2,反应的离子方程式为 。
(5)能表明SO2的还原性强于I-的反应现象为__________________。
(6)装置E的作用为________________。
(7)在上述装置中通入过量的SO2,为了验证C中SO2与Fe3+发生了氧化还原反应,取C中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是 ,理由是 。
从有机反应R—H+Cl2 R—Cl+HCl制取副产品盐酸的设想已成为现实。请根据所给模拟装置图回答下列问题:
R—Cl+HCl制取副产品盐酸的设想已成为现实。请根据所给模拟装置图回答下列问题:
(1)写出实验室制Cl2的离子方程式____________________________________
(2)装置B中盛放的溶液是___________________,作用是____________________。
(3)装置C有三种功能:①_______________;②_______________;③观察气泡的产生情况,便于控制两种气体的配比。
(4)玻璃管E中放在石棉碎块上的碘化钾的作用是:______________。导管末端“肚形”装置的作用是_____________________。
(5)从F中分离出盐酸的最佳方法是_________。该套实验装置还存在的缺陷是 。
(12分)工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式 。
(2)实验装置(如图所示)
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为y g,滴定管的读数为amL。
②称取x g AlN样品置于锥形瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与锥形瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞 ,通过分液漏斗加入过量 (填化学式),与锥形瓶内物质充分反应。
④ (填入该步反应进行的操作)。
⑤记录滴定管的读数为b mL,称得D装置的质量为z g。
(4)数据分析
①AlN的质量分数为 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积______(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为 (该实验条件下的气体摩尔体积为Vm L)。
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:
用如图所示实验装置,在硬质玻璃管B中放入还原铁粉和石棉绒的混合物,再结合一些步骤,就可以完成高温下“Fe与水蒸气的反应实验”(已知石棉绒是耐高温材料,不与水和铁反应)。
Ⅰ.探究“铁与水蒸气”能否发生反应
(1)如何检查该装置的气密性 。
(2)实验中石棉绒的作用是 。
(3)反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当 时(填实验现象),说明“铁与水蒸气”能够进行反应,写出铁与水蒸气反应的化学方程式 。
Ⅱ.探究“铁与水蒸气” 反应的产物
(1)假设还原铁粉反应完全,黑色固体为某种单一成分,为研究黑色固体成分,该研究小组甲同学提出以下假设:
假设一:黑色固体全部是Fe3O4
假设二:黑色固体全部是Fe2O3
假设三:黑色固体全部是FeO
乙同学认为即使不通过实验就可以否定甲同学的一个假设,你认为乙同学否认的假设是 ,理由是 。
(2)若假设一正确,请设计实验加以验证,完成下列表格(仪器自选)。
限选实验试剂:1 mol·L-1硫酸、2 mol·L-1NaOH溶液、新制氯水、澄清石灰水、酸性KMnO4溶液、KSCN 溶液、品红溶液
| 实验步骤 |
预期实验现象与结论 |
| 取反应后干燥的固体于试管中,加入足量的1mol·L-1硫酸溶解 |
|
| |
|
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图。
(1)下列关于图像的说法不正确的是 (填序号,下同);
①a → b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率
②b → c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
①盐酸中c(H+)的浓度更大
②Cl-有催化作用
③SO42-有催化作用
④SO42-有阻化作用(使反应变慢)
⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②加入蒸馏水;③将铝片换成铝粉;④增加硫酸的浓度至18 mol/L;⑤ ;⑥ _。以上方案不合理的有 ;请你再补充两种合理方案,填入空白⑤⑥处。
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气。请用下图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系。
实验测得数据和有关结果如下:
①准确称得无水硫酸铜 2.4 g;
②测出量筒中水的体积,折算成标准状态下气体的体积为112 mL;
③干燥管在实验后质量增加1.28 g;
④实验结束时装置B中的NaHSO3溶液变为Na2SO4溶液(不含其他溶质)。
请回答下列问题:
(1)装置B的作用是 ;发生的化学方程式________________________。
(2)装置C的作用是__________________;干燥管收集到的物质是__________ 。
(3)实验数据测出后,计算出氧气的物质的量有________mol;并据此计算出SO2为_________mol,SO3为___________mol。
(14分)实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: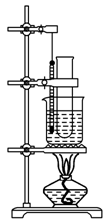
(1)反应需在50℃~60℃的温度下进行,图中给反应物加热的方法是水浴加热,其优点是_____ ___和_____ ___;
(2)在配制混合酸时应将__________加入到________中去;
(3)该反应的化学方程式是________________________________;反应类型:
(4)由于装置的缺陷,该实验可能会导致的不良后果是______ __.
(5)反应完毕后,除去混合酸,所得粗产品用如下操作精制:
①蒸馏 ②水洗 ③用干燥剂干燥 ④用10%NaOH溶液洗 ⑤水洗
正确的操作顺序是 。
| A.①②③④⑤ | B.②④⑤③① | C.④②③①⑤ | D.②④①⑤③ |