肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香。实验室制备肉桂酸的化学方程式为: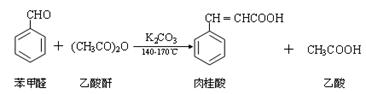
主要试剂及其物理性质
| 名称 |
分子量 |
性状 |
密度g/cm3 |
熔点℃ |
沸点℃ |
溶解度:克/100ml溶剂 |
||
| 水 |
醇 |
醚 |
||||||
| 苯甲醛 |
106 |
无色液体 |
1.06 |
-26 |
178-179 |
0.3 |
互溶 |
互溶 |
| 乙酸酐 |
102 |
无色液体 |
1.082 |
-73 |
138-140 |
12 |
溶 |
不溶 |
| 肉桂酸 |
148 |
无色结晶 |
1.248 |
133-134 |
300 |
0.04 |
24 |
溶 |
密度:常压,25℃测定主要实验步骤和装置如下: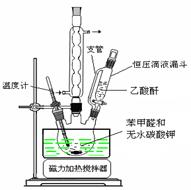
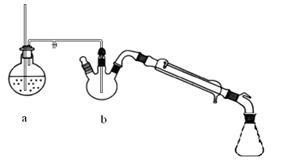
图1 制备肉桂酸的反应装置图 图2水蒸气蒸馏装置图
Ⅰ合成:按图1连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾。在140~170℃,将此混合物回流45min。
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率。同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物。回答下列问题:
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥。实验中为控制温度在140~170℃需在 中加热(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C. 砂子 D.植物油(沸点230~325℃)
反应刚开始时,会有乙酸酐(有毒)挥发,所以该实验应在 中进行操作。
(2)图2中水蒸气蒸馏后产品在 (填仪器名称)
(3)趁热过滤的目的 ,方法: 。
(4)加入1:1的盐酸的目的是 ,析出的肉桂酸晶体通过减压过滤与母液分离。下列说法正确的是 。
A.选择减压过滤是因为过滤速度快而且能得到较干燥的晶体
B.放入比布氏漏斗内径小的滤纸后,直接用倾析法转移溶液和沉淀,再迅速开大水龙头抽滤
C.洗涤产物时,先关小水龙头,用冷水缓慢淋洗
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,再关水龙头
(5)5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾充分反应得到肉桂酸实际3.1g,则产率是 (保留3位有效数字)。
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 |
|
|
| 物质 |
熔点/℃ |
沸点/℃ |
| SiCl4 |
-70 |
57.6 |
| TiCl4 |
-25 |
136.5 |
Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_____,分离二者所采取的操作名称是__。
(2) ③中反应的化学方程式是____________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
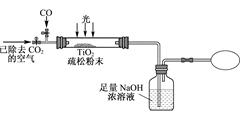
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。
(4) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
(5). 某研究性学习小组用图装置模拟“生态马路”清除CO的原理。(夹持装置已略去)若缓慢通入224L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为___ _________。
(6) 当CO气体全部通入后,还要通一会儿空气,其目的是 。
阿司匹林可由水杨酸与乙酸酐作用制得。其制备原理如下:
主反应: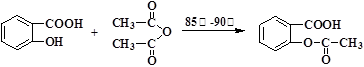 +化合物A
+化合物A
水杨酸 乙酸酐 阿司匹林(乙酰水杨酸)
副反应: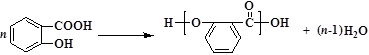
聚水杨酸
已知:① 水杨酸可溶于水,乙酰水杨酸的钠盐易溶于水,聚水杨酸(固体)难溶于水;
② 阿司匹林,白色针状或板状结晶或粉末,微溶于水;阿司匹林可按如下步骤制取和纯化:
步骤1:在干燥的50 mL圆底烧瓶中加入2 g水杨酸、5 mL乙酸酐和5滴浓硫酸,振荡使水杨酸全部溶解;
步骤2:按图所示装置装配好仪器,通水,在水浴上加热5~10min,用电炉控制温度在85~90℃;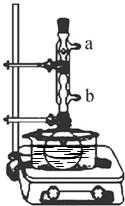
步骤3:反应结束后,取下反应瓶,冷却,再放入冰水中冷却、结晶、过滤、冷水洗涤2~3次,继续过滤得粗产物;
步骤4:将粗产物转移至150 mL烧杯中,在搅拌下加入25 mL饱和碳酸氢钠溶液,充分搅拌,然后过滤;
步骤5:将滤液倒入10 mL 4 mol/L盐酸溶液,搅拌,将烧杯置于冰浴中冷却,使结晶完全。过滤,再用冷水洗涤2~3次。
(1) 主反应中,生成物中化合物A是____________;
(2) 步骤2组装仪器还需要一种玻璃仪器,名称是________,该仪器的位置如何摆放?____________________________;冷凝管的作用是_________,冷凝管通水,水应从______(填“a”或“b”)口进。
(3) 步骤4过滤得到的固体为________;
(4) 经过步骤5得到产物,发生反应的化学方程式为______________________;
(5) 最后得到的阿司匹林可能会有少量未反应的水杨酸。如何用实验的方法检验步骤5中得到的晶体是否含有水杨酸?___________________________________。若阿司匹林晶体含有水杨酸,还需要采用________方法,进一步纯化晶体。
二氧化铈 是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物.。平板电视显示屏生产过程中产生大量的废玻璃粉末(含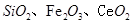 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗净的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
 产品0.536g,加硫酸溶解后,用0.1000mol•
产品0.536g,加硫酸溶解后,用0.1000mol• 溶液(铈被还原为
溶液(铈被还原为 ),消耗25.00mL溶液,该产品中
),消耗25.00mL溶液,该产品中 的质量分数为 。
的质量分数为 。
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
可能用到的有关数据如下:
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填正确答案标号)。
A.立即补加 B. 重新配料 C.不需补加 D.冷却后补加
(3)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的
(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是 。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(6)本实验所得到的环己烯产率是 _(填正确答案标号)。
A.41% B.50% C.61% D.70%
水果成熟时,大多数香气袭人。乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质见右表。合成过程如下:第一步:将丁醇和x的混合液和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯。
| |
乙酸 |
1-丁醇 |
乙酸丁酯 |
| 熔点/℃ |
16.6 |
-89.5 |
-73.5 |
| 沸点/℃ |
117.9 |
117 |
126.3 |
| 密度/g·cm-3 |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
互溶 |
不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有1-丁醇和过量的乙酸外,还装有___________、_________。装置C中冷凝管的作用是: ;
(3)乙酸过量的原因是________________。
(4)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ ___ _
(5)步骤E的操作要领是:①用一只手的手掌压住分液漏斗的塞子并握住分液漏斗;②另一只手握住活塞部分;③ 。
(6)要除去乙酸丁酯中含有的少量乙酸,下列试剂中可选用的是:
A. 饱和NaOH溶液 B. 饱和KHCO3溶液
C.饱和Na2CO3溶液 D. 饱和 K2CO3溶液
E. 饱和KOH溶液 F.过量的 1-丁醇
某学生对与漂粉精的反应进行实验探究:
| 操作 |
现象 |
| 取4 |
部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的 |
|
 |
液面上方出现白雾; 稍后,出现浑浊,溶液变为黄绿色; 稍后,产生大量白色沉淀,黄绿色褪去 |
(1)和
制取漂粉精的化学方程是。
(2)试纸颜色的变化说明漂粉精溶液具有的性质是。
(3)向水中持续通入,未观察到白雾。推测现象
的白雾由
小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的溶液检验白雾,产生白色沉淀。
① 实验目的是。
②由实验不能判断白雾中含有
,理由是。
(4)现象中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和
发生反应。通过进一步实验确认了这种可能性,其实验方案是。
(5)将瓶中混合物过滤、洗涤,得到沉淀
①向沉淀中加入稀
,无明显变化。取上层清液,加入
溶液,产生白色沉淀。则沉淀
中含有的物质是。
②用离子方程式解释现象中黄绿色褪去的原因:。
某酸性工业废水中含有。光照下,草酸(
)能将其中的
转化为
。某课题组研究发现,少量铁明矾[
]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始
和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。

| 实验编号 |
初始 |
废水样品体积 |
草酸溶液体积 |
蒸馏水体积 |
| ① |
4 |
60 |
10 |
30 |
| ② |
5 |
60 |
10 |
30 |
| ③ |
5 |
60 |
测得实验①和②溶液中的浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为(填化学式)。
(3)实验①和②的结果表明;实验①中时间段反应速率
=
(用代数式表示)。
(4)该课题组队铁明矾[]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:起催化作用;
假设二:;
假设三:;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有、
、
、
等,溶液中
的浓度可用仪器测定。)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
二氧化铈()是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
、
、
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:

(1)洗涤滤渣的目的是为了去除(填离子符号),检验该离子是否洗涤的方法是
(2)第②步反应的离子方程式是,滤渣B的主要成分是。
(3)萃取是分离稀土元素的常用方法,已知化合物作为萃取剂能将铈离子从水溶液中萃取出来,
(填"能"或"不能")与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的产品0.536
,加硫酸溶解后,用0.1000
标准溶液滴定终点是(铈被还原为
),消耗25.00
标准溶液,该产品中
的质量分数为。
柠檬酸亚铁()是一种易吸收的高效铁制剂,可由绿矾(
)通过下列反应制备:
下表列出了相关金属离子生成氢氧化物沉淀的
(开始沉淀的
按金属离子浓度为1.0
计算)。
| 金属离子 |
开始沉淀的 |
沉淀完全的 |
| 1. 1 |
3. 2 |
|
| 3. 0 |
5. 0 |
|
| 5. 8 |
8. 8 |
(1)制备时,选用的加料方式是(填字母),原因是。
a.将溶液与
溶液同时加入到反应容器中
b.将溶液缓慢加入到盛有
溶液的反应容器中
c.将溶液缓慢加入到盛有
溶液的反应容器中
(2)生成的沉淀需经充分洗涤,检验洗涤是否完全的方法是。
(3)将制得的加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是。②反应结束后,无需过滤,除去过量铁粉的方法是(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚 铁晶体。分离过程中加入无水乙醇的目的是。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为、
、
) 出发,先 制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备
晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,,得到
溶液,,得到
晶体。

在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。 
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
⑴制取氯气时,在烧瓶里加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验室制Cl2的化学方程式 ;实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
| A.碱石灰 | B.氢氧化钠溶液 | C.饱和食盐水 | D.浓硫酸 |
⑵ 如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气明显少于0. 06 mol。其主要原因有:
①______________________________________ _________,
②__________________________________________________________________________。
⑶ 比较制取氯酸钾和次氯酸钠的条件,二者的差异是
① ;
② 。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。
①下图中符合该晶体溶解度曲线的是_______(填写编号字母);
②从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
⑷ 实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白。
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
______________________________________ |
| 然后溶液从无色逐渐变为_______色 |
______________________________________ |
某化学小组准备用环己醇制备环己烯,查得相关资料如下。
反应原理:
反应物与产物的物理性质:
| |
密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为________________________________。
(2)根据上述资料,装置__________最适宜用来完成本次制备实验。


A B C
(3)制备粗产品
将5 mL________加入试管A中,再加入l0 mL_______,摇匀后放入碎瓷片,缓慢加热至反应完全。
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等。粗产品需依次经过水洗,加碳酸钠溶液洗涤以及第二次水洗。在此过程中加入碳酸钠溶液的目的是_____________;分液时,环己烯应从分液漏斗的_____(填“上”或“下”)口取出。
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入右图所示装置的____________(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 。 
实验室用粗锌与稀硫酸反应制取氢气,利用氢气还原氧化铜来测定铜的相对原子质量。实验装置如下:
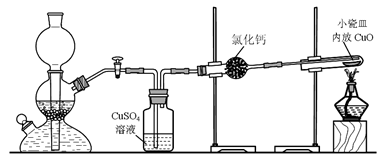
在启普发生器中纯锌与稀硫酸反应过于缓慢,可采取的加快速率的措施是①适当增大硫酸的浓度,②_______________________。
用纯度不高的锌(粗锌)制取氢气,反应速率快,但制得的氢气因含H2S等还原性杂质而有难闻的气味,CuSO4洗气瓶中观察到的现象是_______________,是否可以将CuSO4溶液换成浓硫酸_________(答“是”或“否”) ;理由是__________________________。
有同学发现粗锌与稀硫酸反应一段时间后,锌粒表面变黑,于是收集了少量该黑色固体,验证黑色固体含铁元素的简单化学方法_________________________________________。
实验中得到的数据有:小瓷皿的质量mg,小瓷皿加样品的质量n g,反应后小瓷皿加固体的质量w g,已知氧的相对原子质量为16,则铜的相对原子质量是____________(用含m、n、w的代数式表示)。
某次实验中测定结果明显偏大,可能的原因是________(选填编号)。
a.未充分冷却即停止通氢气 b.氧化铜样品中含有氯化铵杂质
c.反应后固体中有少量Cu2O d.氢气不干燥有少量水分
由于启普发生器药品用量较多,利用下列仪器装配一套有启普发生器功能的简易装置,你选择____________(选填编号) (支撑仪器、橡皮塞、导气管略)。

(a) (b) (c) (d) (e) (f)
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(+2价):NO+FeSO4=Fe(NO)SO4
试回答下列问题:
⑴ 可用上图中装置 (填编号,多选)进行氨气的实验室制备。
D装置可用于下列 (填编号,多选)气体的制备。
a CO2 b O2 c SO2 d C2H4 e C2H2 f H2
⑵ 装置③、④若用同一装置,则该装置中所盛装的药品是 (填编号)
| A.氯化钙 | B.浓硫酸 | C.五氧化二磷 | D.碱石灰 |
⑶ 装置⑥中,粗玻璃管X的作用 ,装置⑦的作用
⑷ 装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸ 当进入装置⑤的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则NO的转化率为 。
三氯化铁熔点282 ℃、沸点315 ℃,能吸收空气里的水分而潮解。它可广泛用于污水处理、电子工业、印染业、建筑业,某化学实验小组的同学欲用下列仪器制备FeCl3固体。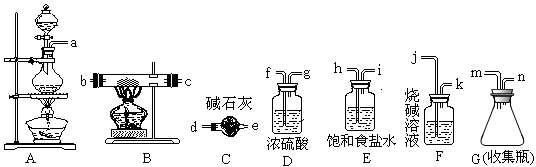
(1)写出制备氯气时的离子方程式_______________________
(2)所选用的仪器连接顺序(填写接口字母)为___________n→d__________
(3)实验过程中,给A、B仪器加热的顺序为_____________________,这样操作的目的是_______________,可作为点燃B处酒精灯的实验标志是_________________;若C可以用D代替,则使用C的目的是______________________。若缺少此类装置,此B中可能发生的另一个反应的方程式为________________________。
(4)有同学认为,若不使用E装置,则B中会有FeCl2生成,请设计一个实验确定此观点是否正确________________________________________________________________。