[江苏]2013年全国普通高等学校招生统一考试化学
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
| A. | 甲醇 | B. | 天然气 | C. | 液化石油气 | D. | 氢气 |
下列有关化学用语表示正确的是( )
| A. | 丙烯的结构简式: |
| B. |
氢氧根离子的电子式:

|
| C. |
氯原子的结构示意图:

|
| D. | 中子数为146、质子数为92 的铀( )原子 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
下列有关物质性质的应用正确的是()
| A. |
液氨汽化时要吸收大量的热,可用作制冷剂 |
| B. |
二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| C. |
生石灰能与水反应,可用来干燥氯气 |
| D. |
氯化铝是一种电解质,可用于电解法制铝 |
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
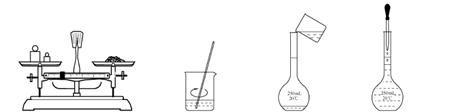
| A. | 称量 | B. | 溶解 | C. | 转移 | D. | 定容 |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。下列有关物质的推断不正确的是()
。下列有关物质的推断不正确的是()
| A. | 若甲为焦炭,则丁可能是 |
| B. | 若甲为 ,则丁可能是氨水 |
| C. | 若甲为 ,则丁可能是盐酸 |
| D. | 若甲为 溶液,则丁可能是 |
设为阿伏加德罗常数的值。下列说法正确的是
下列表示对应化学反应的离子方程式正确的是
 +2
+
↑+2
+2
+
↑+2
电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

| A. | 电极是该电池的正极 |
| B. | 在石墨电极上发生氧化反应 |
| C. | 石墨电极附近溶液的 增大 |
| D. | 溶液中 向正极移动 |
短周期元素、、、 的原子序数依次增大,且原子最外层电子数之和为13。 的原子半径比 的小, 与 同主族, 是地壳中含量最高的元素。下列说法正确的是()
| A. | 原子半径的大小顺序: |
| B. | 元素 、 的简单离子的电子层结构不同 |
| C. | 元素Y 的简单气态氢化物的热稳定性比 的强 |
| D. | 只含 、 、 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
下列有关说法正确的是
反应在室温下可自发进行,则该反应的
电解法精炼铜时,以粗铜作阴极,纯铜作阳极
溶液加水稀释后,溶液中的值减小
溶液中加入少量固体,水解程度减小,溶液的减小
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
| A. | 贝诺酯分子中有三种含氧官能团 |
| B. | 可用 溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与 溶液反应 |
| D. | 贝诺酯与足量 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
下列依据相关实验得出的结论正确的是()
| A. | 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 |
| C. | 将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 |
| D. | 向某溶液中滴加 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含 |
一定温度下,三种碳酸盐的沉淀溶解平衡曲线如下图所示。已知:。下列说法正确的是
一定条件下存在反应:()+2() 2()+2(),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 和1 2,在Ⅱ中充入1 2和1 2,在Ⅲ中充入2 和2 2,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
2()+2(),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 和1 2,在Ⅱ中充入1 2和1 2,在Ⅲ中充入2 和2 2,700℃条件下开始反应。达到平衡时,下列说法正确的是( )
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为,含少量 )为原料制备高纯氧化镁的实验流程如下:
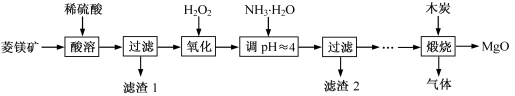
(1)与稀硫酸反应的离子方程式为
(2)加入氧化时,发生反应的化学方程式为
(3)滤渣2 的成分是
(4)煅烧过程存在以下反应:
 ↑↑
↑↑
 ↑↑
↑↑
 ↑↑
↑↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
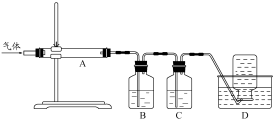
①中收集的气体可以是
②中盛放的溶液可以是
a.溶液 b.溶液 c.稀硝酸 d.溶液
③中得到的淡黄色固体与热的溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
化合物A(分子式为)是一种有机化工原料,在空气中易被氧化。
A 的有关转化反应如下(部分反应条件略去):
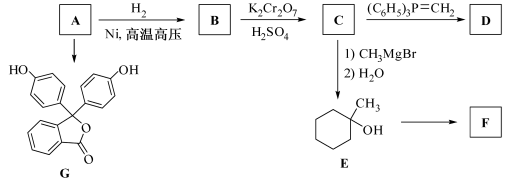
已知:①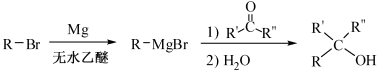
②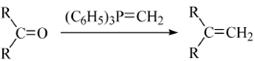
(表示烃基,和表示烃基或氢)
(1)写出 的结构简式:
(2)是常用指示剂酚酞。写出中含氧官能团的名称:
(3)某化合物是的同分异构体,且分子中只有两种不同化学环境的氢。写出该化合物的结构简式:
(4)和互为同分异构体。写出反应→的化学方程式:
(5)根据已有知识并结合相关信息,写出以和为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
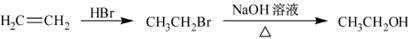
硫酸镍铵[]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 样品,配制成100. 00 溶液;②准确量取25. 00溶液,用0. 04000 的标准溶液滴定其中的(离子方程式为+=+2 ),消耗 标准溶液31. 25 ;③另取25. 00 溶液,加足量的溶液并充分加热,生成56. 00 (标准状况)。
(1)若滴定管在使用前未用 标准溶液润洗,测得的含量将
(2)氨气常用
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
柠檬酸亚铁()是一种易吸收的高效铁制剂,可由绿矾()通过下列反应制备: 下表列出了相关金属离子生成氢氧化物沉淀的(开始沉淀的按金属离子浓度为1.0 计算)。
| 金属离子 |
开始沉淀的 | 沉淀完全的 |
| 1. 1 |
3. 2 |
|
| 3. 0 |
5. 0 |
|
| 5. 8 |
8. 8 |
(1)制备时,选用的加料方式是(填字母),原因是。
a.将溶液与溶液同时加入到反应容器中
b.将溶液缓慢加入到盛有溶液的反应容器中
c.将溶液缓慢加入到盛有溶液的反应容器中
(2)生成的沉淀需经充分洗涤,检验洗涤是否完全的方法是。
(3)将制得的加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是。②反应结束后,无需过滤,除去过量铁粉的方法是(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚 铁晶体。分离过程中加入无水乙醇的目的是。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为、、 ) 出发,先 制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,,得到溶液,,得到 晶体。

磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷()可由、焦炭和在一定条件下反应获得。相关热化学方程式如下:
则 =。
(2)白磷中毒后可用溶液解毒,解毒原理可用下列化学方程式表示:
60能氧化白磷的物质的量是。
(3)磷的重要化合物、和可通过与溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与的关系如图所示。

①为获得尽可能纯的,应控制在;=8时,溶液中主要含磷物种浓度大小关系为。
②溶液显碱性,若向溶液中加入足量的溶液,溶液则显酸性,其原因是(用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇(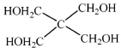 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体,并释放出一种酸性气体。季戊四醇与 的核磁共振氢谱如下图所示。
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体,并释放出一种酸性气体。季戊四醇与 的核磁共振氢谱如下图所示。

①酸性气体是(填化学式)。
②的结构简式为
元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素基态原子的3p 轨道上有4个电子。元素的原子最外层电子数是其内层的3倍。
(1)与所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,离子的数目为。
②该化合物的化学式为。
(2)在的氢化物()分子中,原子轨道的杂化类型是。
(3)的氢化物()在乙醇中的溶解度大于,其原因是。
(4)与可形成
①的空间构型为(用文字描述)。
②写出一种与互为等电子体的分子的化学式:。
(5)的氯化物与氨水反应可形成配合物,1该配合物中含有σ键的数目为。
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 |
沸点/℃ |
熔点/℃ |
密度(20℃) / g·cm-3 |
溶解性 |
| 甲醇 |
64. 7 |
 |
0. 7915 |
易溶于水 |
| 乙醚 |
34. 5 |
 |
0. 7138 |
微溶于水 |
| 3,5-二甲氧基苯酚 |
 |
33 ~36 |
 |
易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的
②萃取用到的分液漏斗使用前需
(2)分离得到的有机层依次用饱和溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和溶液洗涤的目的是
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先
 粤公网安备 44130202000953号
粤公网安备 44130202000953号