以天然盐湖资源中分离出来的芒硝、硫酸工业废气二氧化硫及焦炭等为原料,生产大苏打和摩尔盐,其原料的综合利用率较高。其主要流程如下:
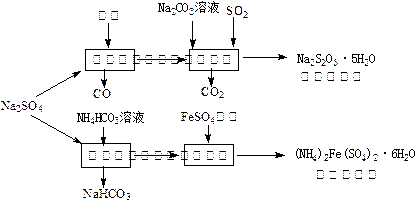
试回答下列问题:
(1)已知反应Ⅰ中发生的主要反应为:Na 2SO 4(s)+4C(s)= Na 2S  (s)+4CO(g)△H="+569.99" kJ/mol,欲使该反应发生并维持该反应进行的条件是 。
(s)+4CO(g)△H="+569.99" kJ/mol,欲使该反应发生并维持该反应进行的条件是 。
(a)常温 (b)常温,并通入少量CO 2 (c)高温,并通入适量的O 2
(2)配平反应Ⅱ的化学方程式: □Na 2S+□Na 2CO 3+□SO 2=□N  a 2S 2O 3+□CO 2
a 2S 2O 3+□CO 2
(3)反应Ⅲ温度需控制在35~40℃的较低温度,其主要原因是 。
(4)在摩尔盐溶液中加入一种物质的溶液可使NH 4 +、Fe 2  +、SO
+、SO 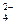 都大量减少,该物质是 。
都大量减少,该物质是 。
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H 2O 2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二  铬(Cr 2O 3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
铬(Cr 2O 3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
(2)已知CCl 4沸点为57.6℃,为保证稳定的CCl 4气流,适宜的加热方式是 。
(3)用右图装置制备CrCl 3时:
主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧  瓶中通人氮气,使CCl 4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl 4,并加热CCl 4,温度控制在5
瓶中通人氮气,使CCl 4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl 4,并加热CCl 4,温度控制在5  0~60℃之间;④反应管出口端出现了CrCl 3升华物时,切
0~60℃之间;④反应管出口端出现了CrCl 3升华物时,切
断加热管式炉的电源;⑤停止加热CCl 4,继续通人氮气; ⑥检查装置气密性。正确的顺序为:⑥→③→ 。
(4)已知反应管中发生的主要反应有:Cr 2O 3+ 3CCl 4→ 2CrCl 3+ 3COCl 2,因光气剧毒,实验  需在通风橱中进行,并用乙醇处理COCl 2,生成一种含氧酸酯(C 5H 10O 3),用乙醇处理尾气的化学方程式为 。
需在通风橱中进行,并用乙醇处理COCl 2,生成一种含氧酸酯(C 5H 10O 3),用乙醇处理尾气的化学方程式为 。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的  锥形瓶)中,加热至沸后加入1gNa 2O 2,充分加热煮沸,适当稀释,
锥形瓶)中,加热至沸后加入1gNa 2O 2,充分加热煮沸,适当稀释,  然后加入过量的2mol/LH 2SO 4至溶液呈强酸性,此时铬以Cr 2O
然后加入过量的2mol/LH 2SO 4至溶液呈强酸性,此时铬以Cr 2O  存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,  用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr 2O  +6I -+14H +=2Cr 3++3I 2+7H 2O,2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI。
+6I -+14H +=2Cr 3++3I 2+7H 2O,2Na 2S 2O 3+I 2===Na 2S 4O 6+2NaI。
①该实验可选用的指示剂名称为 。
②移入碘量瓶的CrCl 3溶液需加热煮沸,加入Na 2O  2后也要加热煮沸,其主要原因是 。
2后也要加热煮沸,其主要原因是 。
③样品中无  水三氯化铬的质量分数为 。
水三氯化铬的质量分数为 。
茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500 g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.1000 mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL,计算结果.请回答下列问题:
步骤 1中:使茶叶灰化需要三角架、泥三角、酒精喷灯、_________、_________等仪 器.
器.
步骤2中:改用试剂________________来调节pH将更为方便.判断沉淀已经洗涤干净的方法是______________________________________________________________.
步骤3中:原茶叶中钙离子的质量分数为________________.若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,则测得的钙离子的质量分数将__________(填下列序号之一:①偏小 ②偏大 ③不偏 ④偏小或偏大或不偏)
今有一混合物的水溶液,只可能含有以下离子中的若干 种:Na+、NH4+、Cl-、Cu2+、Fe3+、CO32—、SO42—,现每次取100.00ml进行下列实验:
种:Na+、NH4+、Cl-、Cu2+、Fe3+、CO32—、SO42—,现每次取100.00ml进行下列实验:
①第一份加入AgNO3溶液有沉淀产生.
②第二份加足量NaOH后加热,收集到气体0.896L(标准状态下).
③第三份加足量BaCl2后,得干燥沉淀6.27g,沉淀经足量盐酸洗涤干燥后,剩余2.33g.在原溶液中一定存在的离子及其物质的量浓度分别为: _______________ .
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO  N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应,A中加的是氯化铵和氢氧化钙固体,C中的固体是氧化铜。回答下列问题:
(1)A中发生反应的化学方程式是 。
检验氨气通常采用的方法是________ _,其现象是__ ________。
(2)B中加入的物质是 ,其作用是 。
(3)实验时C中观察到的现象是  ,该反应中氨的作用是_______(填氧化剂或还原剂)。
,该反应中氨的作用是_______(填氧化剂或还原剂)。
(4)实验时在D中收集到的液态物质是 ,E中收集到的气体是__________。
(5)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,(一种类似于U型管作用,内装固体干燥剂的管子)第一个干燥管X内装有______,现象是_______;第二个干燥管Y内装有碱石灰,作用是_____________。
废旧塑料回收和利用是减轻“白色污染”、实现资源再利用的有效途径之一。某兴趣小组进行如下探究:
[实验课题]废旧聚丙烯塑料热分解主要产物的探究
[查阅资料]①石蜡热分解的产物为常温下的气态烃和液态烃
②CuO能将烃氧化成CO2和H2O
③苯甲酸能溶于苯
[实验设计][
[实验记录]
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E装置中黑色氧化铜变红;④F装置中无水硫酸铜变蓝。
[问题讨论]请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管 中的液态产物是甲苯和苯的混合物。若要除去其中的甲苯,
中的液态产物是甲苯和苯的混合物。若要除去其中的甲苯,
实验操作方法是
(2)C装置的作用是 ;
(3)如果不设置D装置,对实验结论产生的影响是
 。
。
(4)甲同学认为从C中出来的气体是氢气,乙同学认为还可能有其它成分。你认为其
他成分可能是 。为完善实验设计,请在上图方框内画出装置图并注明其中盛放的试剂名称。
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。如图是用燃烧的方法确定有机物分子式的常用装置。
试回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是_____________ 。
(2)C装置中浓硫酸的作用是_______________。
(3)燃烧管中CuO的作用是_______________。
(4)若准确称取0.48 g样品,经充分燃烧,A管质量增加1.32 g,B管质量增加1.0 8 g,则该有机物是否含氧元素 ? ______填(有、无)该有机物的分子式为_______
8 g,则该有机物是否含氧元素 ? ______填(有、无)该有机物的分子式为_______
( 12分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出 制取乙酸乙酯的化学反应方程式
制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液,通常的顺序是:
。
(3)浓硫酸的作用是: ;。
(4)饱和碳酸钠溶液的主要作用是 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应 的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸④正反应的速率与逆反应的速率相等⑤混合物中各物质的浓度不再变化
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ; (2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性:
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
。
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+ 的稳定性比Cu2+ 差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却 后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是__________________
后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是__________________ ______________。
______________。
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。
| 棉球 |
棉球上滴加试剂 |
实验现象 |
解释或结论 |
| a |
_______________ |
棉球变白,微热后又恢复红色 |
解释:__________________ 结论:该气体具有漂白性。 |
| b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: _________________________ |
| c |
淀粉和___________的混合溶液 |
棉球变为白色 |
化学方程式:_________________ 结论:该气体具有_________性。 |
(2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。
① 用此装置模拟工业合成盐酸,则关于试剂选择正确的是________(填序号),管口可观察到_______色火焰。
| |
溶液A |
固体B |
气体C |
| a. |
稀硫酸 |
Zn |
Cl2 |
| b. |
浓盐酸 |
MnO2 |
H2 |
| c. |
稀硝酸 |
Fe |
Cl2 |
| d. |
浓盐酸 |
KMnO4 |
H2 |
②若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓烈的黑烟,则固体B为_________(填化学式)。此火焰温度极高,常用于切割焊接金属。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均 不带结晶水)
不带结晶水)
Ⅰ.按照甲同学的观点,发生反应的离子反应方程式为 ;
在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 、 、 。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为 → → 。
(2)能证明生成物中有CuCO3的实验现象是 。
Ⅲ.若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。

(1)装置C中碱石灰的作用是 ,实验开始和结束时都要通入过量的空气,请说明结束时通入过量空气的作用是
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为 。
某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙两套装置(图中的夹持仪器均未画出,"△"表示酒精灯热源),每套装置又可划分为①、②  、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b
、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b  -铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。
-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。

(1)对比两套方案,简述各自的优点:
甲_______________________________
________________________________。
乙_______________________________
________________________________。
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为1.甲①(接干燥管) 2. _______ 3. _______(例如甲①,乙②)
(3)实验中钢丝的作用是_________________。
(4)实验中能验证乙醇氧化产物的实验现象是______________________________________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式_________________________。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答:
(1) 装置A中发生的化学反应方程式为 。(2) 装置D中试管口放置的棉花中应浸一种液体,这种液体是  ,
,
其作用是 。
(3) 装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K并移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是 。_B中应放置的液体是(填字母) 。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4) 实验中,取一定质量的铜片和一定体积18 mol·L—1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
① 有一定量的余酸但未能使铜片完全溶解,你认为原因是
。
② 下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液
1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下: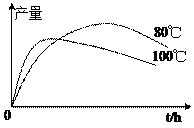
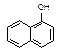 +C2H5OH
+C2H5OH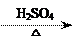
 +H2O
+H2O
1-萘酚  1-乙氧基萘
1-乙氧基萘
⑴将72 g 1-萘酚溶于100 mL无水乙醇中,加入5 mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是 ▲ 。烧瓶上连接长直玻璃管的主要作用是 ▲ 。
⑵反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作: ①蒸馏②水洗并分液 ③用10%的NaOH溶液碱洗并分液 ④用无水氯化钙干燥并过滤。正确的顺序是 ▲ 。
A.③②④① B.①②③④ C.②①③④
⑶蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有 ▲ 。
⑷实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高1-乙氧基萘的产量下降的原因可能是 ▲ 、 ▲ 。
⑸用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论: ▲ 。