某气态烃A在标准状况下的密度为1.25g/L,其产量可以用来衡量一个国家的石油化工发展水平。B和D都是生活中常见的有机物,D能跟碳酸氢钠反应,F有香味。它们之间的转化关系如下图所示:



 (1)A的结构式为 ,B中官能团的电子式为 ,
(1)A的结构式为 ,B中官能团的电子式为 ,
 D中官能团的名称为 。
D中官能团的名称为 。
 (2)反应①的反应类型是 ,
(2)反应①的反应类型是 ,
反应③的化学方程式为 。
。


 (3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是 。该反应的化学方程式为 。
(3)反应②在Cu做催化剂的条件下进行,该实验的步骤是将红亮的铜丝置于酒精灯上加热,待铜丝变为黑色时,迅速将其插入到装有B的试管中(如图所示)。重复操作2-3次,观察到的现象是 。该反应的化学方程式为 。
 (4)D与碳酸氢钠溶液反应的离子方程式为 。
(4)D与碳酸氢钠溶液反应的离子方程式为 。
 (5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:
(5)B、D在浓硫酸的作用下实现反应④,实验装置如下图所示:

 试管1中装药品的顺序为先取 (填“B”、“D”、“浓硫酸”,下同),再加入 ,最后加入 。图中X的化学式为 。
试管1中装药品的顺序为先取 (填“B”、“D”、“浓硫酸”,下同),再加入 ,最后加入 。图中X的化学式为 。
 浓硫酸的作用是 。
浓硫酸的作用是 。
 该反应的化学方程式为 。
该反应的化学方程式为 。
乙二酸(H2C2O4)俗名草酸,草酸易溶于水,市售消字灵一般为高锰酸钾和草酸的混合溶液。
(1) 在KMnO4与H2C2O4反应中,可通过测定____________来测定该反应的速率;写出酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn2+的离子反应方程式:_______________ _____________;
(2) 某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得,H2C2O4水溶液可以用酸性KMnO4溶液进行滴定
该组同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③已知用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,逐滴加入到装有草酸溶液的锥形瓶中,到滴定终点时,停止滴定。开始时读数及恰好反应时KMnO4溶液的读数见下表。
| 实验编号 |
待测草酸溶液体积(mL) |
滴定开始读数(mL) |
滴定结束读数(mL) |
| ① |
25.00 |
0.00 |
10.00 m |
| ② |
25.00 |
1.00 |
11.02 |
| ③ |
25.00 |
0.22 |
12.00 |
请回答:滴定时,将KMnO4标准液装在 (填“酸式滴定管”或“碱式滴定管”)中。
请在下面空白处通过上述数据,计算出待测的草酸的物质的量浓度 mol/L。计算出x= 。若滴定终点时俯视滴定管刻度,则由此测得的x值会 ;若滴定后,滴定关尖嘴处有气泡,则由此测得的x值会 。填“偏大”、“偏小”或“不变”)。
某化学实验小组,通过Li3N固体水解生成氢氧化锂和氨气的反应制氨气,并进行氨气还原氧化铜的实验探究。如下图所示,给出了本实验可供选择的装置:
请回答下列问题:
(1)按该方法制氨气时,应选用上述装置中的 (填装置代码,下同)做氨气发生装置。
(2)为检验氨气还原氧化铜反应后生成Cu、H2O、N2,氨气发生装置后应依次连接 → C → → →
(3)在C装置前后连接的装置中,填充的药品按前后顺序分别为 、 。
(4)有资料提出:CuO被还原时,当黑色固体完全变为红时,不一定完全转化为Cu,可能还含有Cu2O。已知查阅到一离子反应方程式:Cu2O+2H+=Cu2++Cu+H2O。依据该信息,若证明C处的红色固体中是否含有Cu2O ,请设计实验: 。
(5)实验时充分加热,至C装置质量不再减轻为止。实验完毕后,若实验测得收集的N2体积为aL(已折算为标准状况)。则若用CH4还原同样多CuO,理论上最少需要CH4的体积为(标准状况,用含字母a的代数式表示) L。
某品牌消毒液包装说明中的部分内容摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用。切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉暗处保存。
(一)从以上材料获得的信息有:
(1)该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液可能具有的化学性质是_________性和________性(任意写出两种)。
(3)推测造成该消毒液失效的外界因素可能有____或 (任意写出两种),写出其中一种因素引起该消毒液失效涉及的化学反应方程式____。
(二)对该消毒液提出探究的问题:它对碳钢制品是否有腐蚀作用?
(三)方案设计与探究实施
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯,浸泡一段时间。观察到的现象,假设:①.有明显现象;②.无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是______。
(5)基于假设②,结论是____,请设计实验进一步验证该结论,叙述实验操作:___。
1942年,我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3进而生产出纯碱,他的“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:NH3+CO2+H2O NH4HCO3;
NH4HCO3+NaCl NaHCO3↓+NH4Cl ; 2NaHCO3  Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因 (选填字母)。
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按设计的方案进行实验。将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。请回答:

①写出甲中发生反应的离子方程式 。
②乙装置中的试剂是 。
③实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法(用简要的文字和相关的化学反应方程式来描述):
Ⅰ下面是几种实验中常用的仪器:
写出序号所代表的仪器的名称:
A___________;B___________;C___________;D___________
Ⅱ实验室要配制100 mL 2 mol/L NaOH溶液,请回答下列问题:
(1)配制过程中不需要使用的化学仪器有__________________(填选项的字母)。
| A.烧杯 | B.100 mL容量瓶 | C.漏斗 | D.胶头滴管 E.玻璃棒 |
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)下列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1-2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③待冷却至室温后,将溶液转移到100 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度________(填 “偏高”或 “偏低”或 “不变” )。
写出实验室制氨气的化学方程式:_____________________________________________。
在下图方框内画出氨气的收集装置(夹持装置可略去)
(1)浓硫酸与木炭粉在加热条件下反应。已知酸性KMnO4溶液可以吸收SO2,试用下图所示各装置设计一个实验,验证上述反应所产生的各种产物。
这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号):
__________→__________→__________→__________。
(2)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是_____________,B瓶溶液的作用是____________________,C瓶溶液的作用是_________________________。
(3)装置②中所加的固体药品是_______________,可确证的产物是_______,确定装置②在整套装置中位置的理由是_____________________。

(12分)下图为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热仪器、铁架台、铁夹等均未画出)。图中:A处为无水乙醇(沸点为78℃);B处为绕成螺旋状的细铜丝或银丝;C处为无水CuSO4粉末;D处为碱石灰;F处为新制的碱性Cu(OH)2悬浊液。
(1)在上述装置中,实验时需要加热的仪器按加热的先后顺序排列为(填序号)_________________,E处是一种纯净物,其发生反应的化学方程式为 。
(2)为使A中乙醇平稳气化成乙醇蒸气,常采用的方法是 ,D处使用碱石灰的作用是 。
(3)能证明乙醇反应后所生成的产物的实验现象是 。
(4)本实验中若不加热E处,其他操作不变,则发现C处无明显变化,而F处现象与(3)相同,B处发生反应的化学方程式是 。
在试管A中加入3ml乙醇,然后边振荡管边慢慢加入2ml浓硫酸和2ml乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。
(1)试管B中盛放的试剂是____________(填名称)
(2)乙醇与乙酸反应的化学方程式是_________________________________。
(3)实验完成后,试管B的液面上有透明的不溶于水的油状液体产生。若要分离B中的液体混合物需要用到的玻璃仪器是____________________。
(4)用30g乙酸与46g乙醇反应,如果实验产率是理论产率的60%,则可等到的乙酸乙酯的质量是__________g(精确到0.1)
实验室用如图所示的装置制取乙酸乙酯.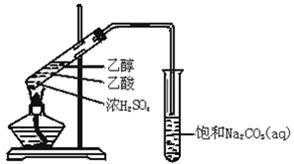
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是: ,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管_________________________,目的是_______________。
(3)浓硫酸的作用是①___________;②___________.
(4)饱和Na2CO3溶液的作用是①________________________;②_____________________;
③_____________________________。
(5)生成的乙酸乙酯的化学方程式 。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
(共15分)I(1)为比较Fe3+ 和Cu2+ 对H2O2分解的催化效果,甲、乙两位同学分别设计了如图所示的实验。
甲、乙两同学可通过观察 ,定性比较得出结论。观察两同学的方案,你认为 (填“甲”或“乙”)更合理。理由是 。
(2) 丙同学另外设计了如下实验验证过氧化氢酶对H2O2分解的作用(新鲜鸡肝片中含有过氧化氢酶):
①在试管A中加入3%的双氧水5 mL,再加入新鲜的鸡肝片1 g,有气体产生;
②在试管B中加入3%的双氧水5 mL,再加入煮熟的鸡肝片1 g,无气体产生;
③在试管C中加入3%的双氧水3 mL和10%的H2SO42 mL,再加入新鲜的鸡肝片1 g,无气体产生。
由上述实验得到的结论是
_______________________________________________________________________,
_______________________________________________________________________。
写出①中产生气体的化学方程式:_____________________________________。
(10分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准硫酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入甲基橙作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗硫酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗硫酸为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(3)上述操作步骤中两处错误分别是 ,
(请指出具体错误)。由此造成的测定结果分别是 , (填偏高、偏低或无影响)。
(4)某次滴定时的滴定管中的液面如图,则其读数为 mL。若记录读数时,起始时俯视,终点时仰视,则所测溶液浓度会 (填偏高、偏低或无影响)。
(5)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准硫酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.45 |
| 第二次 |
20.00 |
4.00 |
29.05 |
请计算待测烧碱溶液的浓度为 mol/L。
某校化学小组的同学用如图装置对炭与浓硫酸的反应的产物进行验证,请回答以下问题:
(1)A中炭与浓硫酸反应的化学方程式 ;
(2)若要验证炭与浓硫酸反应的产物,用BCDE装置进行验证,所用药品如下
| A.品红溶液 | B.酸性高锰酸钾溶液 |
| C.澄清石灰水 | D.氢氧化钠溶液 |
其中B装置中的药品为 ,其作用是 ;
C装置中的药品 ,其作用是 ;
D装置中的药品 ,其作用是 ;
E装置中的药品 ,其作用是 。