江苏省淮安市淮阴区高一下学期期末调查测试化学卷
世界气候大会于2009年12月在丹麦首都哥本哈根召开,商讨2012至2020年全球温室气体减排协议。下列物质属于温室气体的是
| A.N2 | B.H2 | C.CO2 | D.O2 |
F和F—两种粒子中,不相同的是
①核内质子数②核外电子数③最外层电子数④核外电子层数
| A.①② | B.②③ | C.③④ | D.②③④ |
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数和核外电子数之差为
| A.57 | B.47 | C.61 | D.293 |
下列混合物,能用分液漏斗分离的是
| A.乙酸乙酯和水 | B.酒精和水 | C.植物油和乙醇 | D.汽油和煤油 |
关于化学键的下列叙述中,正确的是
| A.离子化合物可能含共价健 |
| B.共价化含物可能含离子键 |
| C.离子化合物中一定不含共价键 |
| D.共价化含物中一定含离子键 |
下列化学用语错误的是
A.NaCl的电子式 |
B.甲烷的结构式 |
C.Mg原子结构示意图 |
D.乙烯的结构简式CH2=CH2 |
下列反应的离子方程式书写正确的是
| A.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑ |
| B.稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ |
| C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓ |
| D.氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu |
石油是一种不可再生能源,2008年1月2日纽约市场原油期货价格一度突破每桶100美元的关口。下列有关石油的说法中不正确的是
| A.石油被称为“工业的血液” |
| B.衡量一个国家石油化工工业水平发展的标志是乙烯的产量 |
| C.石油的主要成分与植物油相同 |
| D.在海洋里航行的油轮发生泄漏时,会对海洋产生严重的污染 |
一定条件下,在容积固定的某密闭容器中发生的反应N2+3H2 2NH3。在10s内N2的浓度由5mol/L降至4mol/L。下列说法正确的是
2NH3。在10s内N2的浓度由5mol/L降至4mol/L。下列说法正确的是
| A.用NH3表示的化学反应速率为0.1mol/(L·s) |
| B.使用合适的催化剂,可以加快该反应的速率 |
| C.增加H2的浓度或降低温度都会加快该反应的速率 |
| D.反应足够长时间,N2、H2中至少有一种物质浓度降为零 |
在无色透明溶液中,能大量共存的离子组是
| A.Mg2+、Na+、SO42- | B.K+、H+、HCO3- |
| C.Cu2+、NO3-、SO42- | D.Ba2+、NO3-、CO32- |
如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。下列叙述正确的是 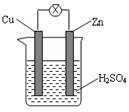
| A.该装置将化学能转变为电能 | B.电流从锌片流向铜片 |
| C.一段时间后,铜片质量减轻 | D.锌片发生还原反应 |
对于反应中的能量变化,表述正确的是
| A.放热反应中,反应物的总能量大于生成物的总能量 |
| B.断开化学键的过程会放出能量 |
| C.加热才能发生的反应一定是吸热反应 |
| D.氧化反应均为吸热反应 |
用 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
A. 中含有的原子数为 中含有的原子数为 |
B. 中含有的氢原子数为2 中含有的氢原子数为2 |
C.常温常压下,11.2L 中含有的分子数为0.5 中含有的分子数为0.5 |
D.1L0.1mol·L-1NaNO3溶液中含有的钠离子数为 |
下列溶液中的Cl-浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是
| A.150 mL 1 mol·L-1 NaCl溶液 | B.75 mL 0.5mol·L-1CaCl2溶液 |
| C.150 mL 2 mol·L-1 KCl溶液 | D.75 mL 1 mol ·L-1AlCl3溶液 |
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |
对于某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ |
(共15分)I(1)为比较Fe3+ 和Cu2+ 对H2O2分解的催化效果,甲、乙两位同学分别设计了如图所示的实验。
甲、乙两同学可通过观察 ,定性比较得出结论。观察两同学的方案,你认为 (填“甲”或“乙”)更合理。理由是 。
(2) 丙同学另外设计了如下实验验证过氧化氢酶对H2O2分解的作用(新鲜鸡肝片中含有过氧化氢酶):
①在试管A中加入3%的双氧水5 mL,再加入新鲜的鸡肝片1 g,有气体产生;
②在试管B中加入3%的双氧水5 mL,再加入煮熟的鸡肝片1 g,无气体产生;
③在试管C中加入3%的双氧水3 mL和10%的H2SO42 mL,再加入新鲜的鸡肝片1 g,无气体产生。
由上述实验得到的结论是
_______________________________________________________________________,
_______________________________________________________________________。
写出①中产生气体的化学方程式:_____________________________________。
利用含淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)写出化学方程式,并注明反应类型:
①B与醋酸反应:_____________________________________,_________________反应。
②B→C:___________________________________________,_________________反应。
(2)可用于检验A的试剂是_________________________________________。
已知有以下物质相互转化。试回答:
(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出向G溶液加入A的有关离子反应方程式 。
(10分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。
第二份加足量NaOH溶液加热后,收集到0.08 mol气体。
第三份加足量BaCl2溶液后,得到干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g.。
根据上述实验,回答以下问题:
(1) 由第一份进行的实验推断该混合物是否一定含有Cl-
(2) 由第二份进行的实验得知混合物中应含有 离子,其物质的量浓度为
(3) 由第三份进行的实验可知12.54g沉淀的成分为
请计算形成该沉淀的原混合物中各离子的物质的量。(要求写出计算过程)
(4) 综合上述实验,你认为以下结论正确的是
| A.该混合液中一定含有:K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol |
| B.该混合液中一定含有:NH4+、CO32-、SO42-,可能含K+、Cl- |
| C.该混合液中一定含有:NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl- |
| D.该混合液中一定含有:NH4+、SO42-,可能含Mg2+、K+、Cl- |


 粤公网安备 44130202000953号
粤公网安备 44130202000953号