辽宁省大连长海高中高一下学期期末考试化学卷
关于化学键的下列叙述中,正确的是( )
| A.离子化合物中只含离子键 | B.共价化合物中只含非金属元素 |
| C.离子化合物中可能含共价键 | D.离子化合物中一定含有金属离子 |
下列化学用语表示正确的是( )
A.二氧化碳的电子式为: |
B.乙烷的结构式为 |
C.甲烷的比例模型为: |
D.Cl-离子的结构示意图: |
误食铜、铅、汞盐中毒后,可以采取的急救措施是( )
| A.喝大量牛奶 | B.喝大量水 | C.喝大量葡萄糖水 | D.喝一些食醋 |
等物质的量的下列烃完全燃烧,消耗氧气最多的是( )
| A.CH4 | B.C5H12 | C.C3H8 | D.C2H6 |
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到平衡状态的是( )
| A.2v正(H2)=3v逆(NH3) | B.v正(N2)=v逆(NH3) |
| C.v正(N2)=3v逆(H2) | D.v正(N2)=v正(H2) |
将浓溴水加入苯中,溴水的颜色变浅,这是由于发生了( )
| A.化学反应 | B.取代反应 |
| C.加成反应 | D.萃取过程 |
下列有机物命名正确的是 ( )
| A.2,4,4-三甲基戊烷 | B.2-乙基丁烷 |
| C.2,2,3,4-四甲基戊烷 | D.3,4,4-三甲基戊烷 |
SO2、NO2是大气污染的主要污染物,下列污染现象分别与SO2、 NO2有关的是( )
| A.光化学烟雾、温室效应 | B.臭氧空洞、水体富营养化 |
| C.酸雨、光化学烟雾 | D.赤潮、温室效应 |
制取较纯的一氯乙烷,用下列哪种方法( )
| A.乙烷和氯气取代 | B.乙烯加成氢气,再用氯气取代 |
| C.乙烯和氯化氢加成 | D.乙烯和氯气加成 |
乙醇分子中不同的化学键如图所示,乙醇各种反应中应断裂的键说明不正确的是( )
| A.和金属钠作用时,键①断裂 |
| B.和浓H2SO4共热至170℃时,键②和⑤断裂 |
| C.和CH3COOH共热时,键②断裂 |
| D.在Ag催化剂下和O2反应时,键①和③断裂 |
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
| A.同周期元素中X的金属性最强 |
| B.原子半径X>Y,离子半径X+>Z2- |
| C.同族元素中Z的氢化物稳定性最高 |
| D.同周期元素中Y的最高价含氧酸的酸性最强 |
在一个固定体积的密闭容器中加入2mol A,发生可逆反应2A(g)  2B(g)+C(g)。该反应达到平衡的标志是( )
2B(g)+C(g)。该反应达到平衡的标志是( )
A.容器内压强是开始时的1.5倍
B.容器内A、B、C物质的量浓度之比为2∶2∶1
C.单位时间消耗0.2molA同时生成0.1molC
D.容器内各物质的浓度不随时间变化
山梨酸是一种常见的食物添加剂,它是一种无色针状晶体或白色粉末,它的结构简式为CH3—CH=CH—CH=CH—COOH。下列关于山梨酸的叙述不正确的是( )
| A.山梨酸易溶于乙醇 | B.山梨酸能与氢气发生加成反应 |
| C.山梨酸能和乙醇反应生成酯 | D.1mol山梨酸和金属钠反应生成1mol氢气 |
有甲烷和氢气的混合气体VL,完全燃烧需要氧气的体积在相同状况下也是VL,则原混合气体中,甲烷和氢气的体积比为( )
| A.1∶1 | B.1∶2 | C.2∶1 | D.3∶1 |
糖类、脂肪和蛋白质是人体生命活动必需的三大营养物质。以下叙述正确的是( )
| A.植物油不能使溴的四氯化碳溶液褪色 |
| B.葡萄糖能发生银镜反应和水解反应 |
| C.淀粉水解的最终产物是葡萄糖 |
| D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
下列金属冶炼的反应原理,错误的是( )
|
A.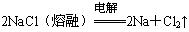 |
B.MgO+H2 Mg+H2O Mg+H2O |
C.Fe2O3+3CO  2Fe+3CO2 2Fe+3CO2 |
D.2HgO  2Hg+O2↑ 2Hg+O2↑ |
下列用水就能鉴别的一组物质是 ( )
| A.苯、己烷、四氯化碳 | B.苯、乙醇、四氯化碳 |
| C.溴苯、乙醇、四氯化碳 | D.溴苯、乙醇、乙酸 |
烃 是由某烯烃A在一定条件下与氢气按1:1的体积比加成生成的,则由此可推断出烯烃A可能的结构有几种
是由某烯烃A在一定条件下与氢气按1:1的体积比加成生成的,则由此可推断出烯烃A可能的结构有几种
| A.9种 | B.7种 | C.5种 | D.4种 |
有两种气态烃组成的混和气体,对氢气的相对密度为13,取此混和气体4.48L(标准状况下)通入足量溴水,溴水增重2.8g,则此混和气体的组成是( )
| A.CH4与C3H6 | B.C2H4与C3H6 |
| C.C2H4与CH4 | D.CH4与C4H8 |
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要 _ ,形成化学键要 。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘反应生成1 mol HI需要 __ (填“放出”或“吸收”) ___ kJ的热量。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,可用来点火做饭。已知8g甲烷完全燃烧生成液态水时放出445.0kJ的热量,请写出甲烷燃烧热的热化学方程式____________________________________。
(3)在生产和生活中经常遇到化学能与电能的相互转化。
在如图甲、乙两装置中,甲中负极电极反应式为_____________________,
溶液中的阳离子向_____极移动(填“正”或“负”);乙中铝电极作__________极,发生______反应(填“氧化”或“还原”)。
在一定温度下,10L密闭容器中加入5molSO2、3molO2,反应达平衡时有3molSO2发生了反应。试填写下列空格:
(1)生成SO3 _________ mol;
(2)O2的转化率为_____________;
(3)平衡时体系中SO2的百分含量(体积分数)为 __________;
(4)降低温度,O2的转化率____________;v正____________;(填“增大”、“减小”或“不变”)
(5)保持容器体积不变,加入He,则SO2的物质的量__________。(填“增大”、“减小”或“不变”)
A是一种气态烃。B和D是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯,其合成路线如下图所示:
(1)A的结构式为_____________
(2)A—→B的反应类型为_____________________
(3)D的水溶液与氢氧化钠反应的离子方程式为________________________
(4)B与钠反应的化学方程式为__________________________
(5)反应③的化学反应方程式为:____________________
取标准状况下2.24L某气态烃置于密闭容器中,再通入足量的O2 ,用电火花引燃,燃烧产物的定量测定实验数据如下(图中的箭头表示气体的流向)。
通过计算回答:
(1)该烃的分子式___________________
(2) 写出可能的结构简式___________________ , ___________________ 。
实验室用如图所示的装置制取乙酸乙酯.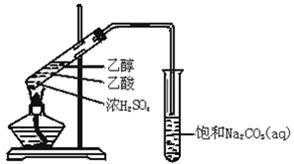
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液的方法是: ,然后轻轻振荡试管,使之混合均匀。
(2)装置中通蒸气的导管_________________________,目的是_______________。
(3)浓硫酸的作用是①___________;②___________.
(4)饱和Na2CO3溶液的作用是①________________________;②_____________________;
③_____________________________。
(5)生成的乙酸乙酯的化学方程式 。
(6)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是_____________(填物质名称).
 粤公网安备 44130202000953号
粤公网安备 44130202000953号