二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式___ _____。
(2)已知:Se + 2H2SO4(浓) → 2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O → Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目________________________________。
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关。
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2。
则MnO2在下述变化中的作用与NO2在上述过程中的作用相似的是 (填选项)
A.实验室用MnO2和浓盐酸混合加热制氯气
B.实验室用氯酸钾和MnO2混合加热制氧气
C.双氧水加入MnO2制氧气
D.高锰酸钾受热分解为二氧化锰、锰酸钾和氧气
(2)请写出用上述选项A实验室制氯气反应的离子方程式 ,若利用B和C制备等量的氧气,则转移的电子数目之比为 。
(3)很多现代化的纯碱厂,纯碱生产工艺仍沿用我国化学家侯德榜改进的纯碱生产工艺,其生产流程可简要表示如下:

①上述生产纯碱的方法称侯德榜制碱法,沉淀池中发生的化学反应方程式是 。
②检验产品碳酸钠中是否含有氯化钠的操作方法为 。
③写出上述流程中X物质的分子式 ,副产品的一种用途为 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收二氯化锰。将废旧锌锰电池处理,得到含MnO(OH)混合物,向该混合物加入浓盐酸并加热,试写出MnO(OH)与浓盐酸反应的化学方程式: 。
(2)制备锰锌铁氧体。锰锌铁氧体可用作隐形飞机吸收雷达波的涂料。一种以锌锰废电池为原料制备锰锌铁氧体的主要流程如下:

除汞时,铁粉的作用是______________ _(填“氧化剂”或“还原剂”或“吸附剂”);MnxZn1-xFe2O4中Fe元素为+3价,则Mn元素的化合价为 。
(3)在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如下图。

据图说明pH对Hg吸收率的影响规律 ;在强酸性环境下Hg的吸收率高的原因可能是 。
(4)锰回收新方法。向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为:2MnO(OH)+ MnO2+2H2C2O4 +3H2SO4 = 3MnSO4+ 4CO2↑+6H2O
①每1molMnO2参加反应时,共有 mol电子发生转移。
②新方法的优点是 (答1点即可)。
研究氮、硫及卤素(F、Cl、Br、I)等单质及其化合物的反应在工农业生产、日常生活和环境保护中有重要意义。
(1)工业上利用氨在催化剂存在的情况下与氧气反应来制备生产硝酸所需要的一氧化氮,该反应的化学方程式为 。NH3的电子式为 。硝酸生产过程中排放出来的一氧化氮是大气污染物之一,目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把一氧化氮还原成无色无毒气体,直接排入空气中,有关反应的化学方程式为 。
(2)已知在加热条件下浓硫酸能将木炭粉氧化,该反应的化学方程式为 。某学习小组设计实验来验证上述反应所产生的各种产物,将该反应生成的气体依次通过①装有无水硫酸铜的U型管 ②装有品红溶液的洗气瓶 ③装有酸性KMnO4溶液的洗气瓶 ④装有品红溶液的洗气瓶 ⑤装有澄清石灰水的烧杯,实验中能说明产物内含有CO2的现象是 。
(3)某学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。该小组设计的实验操作依次为:①向NaBr溶液中通入氯气 ②向KI溶液中通入氯气,若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是 (用离子方程式表示)。从原子结构的角度解释氯、溴、碘氧化性逐渐减弱的原因是 。
过渡金属元素铁能形成多种配合物,如:Fe(CO)x等。
1.①基态Fe3+的M层电子排布式为 .
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x= . Fe(CO)x常温下呈液态,熔点为﹣20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型).
2.O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 .已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm.(用含ρ、NA的计算式表示)

3.下列说法正确的是
A. 第一电离能大小:S>P>Si
B. 电负性顺序:C<N<O<F
C. 因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D. SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E. 分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:

已知:①室温下Ksp[Mg(OH)2]=6.0×10﹣12.②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是 ;
(2)若室温下的溶液中Mg2+的浓度为6.0mol•L﹣1,则溶液pH≥ 才可能产生Mg(OH)2沉淀;
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是 ,滤渣的主要成分是 ;
(4)从滤液Ⅱ中获得MgSO4•7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入 ;②过滤,得沉淀;③ ;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品;
(5)若获得的MgSO4•7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为 (MgSO4•7H2O的相对分子质量为246);
铁及其化合物在生产、生活中有广泛应用,请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)  Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K= ;△H 0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是 .
| A.提高反应温度 | B.移出部分CO2 |
| C.加入合适的催化剂 | D.减小容器的容积 |
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正 υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)= .
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是 ;生成0.5mol K2FeO4转移电子的物质的量是 mol.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为 .

分X、Y、Z、M、G五种元素分属三个短周期;且原子序数依次增大。X、Z同主族;可形成离子化合物ZX;Y、M同主族;可形成MY2、MY3两种分子。请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式);非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH ="-a" kJ·mol-1;写出X2M燃烧反应的热化学方程式: 。
(5)ZX的电子式为 ;ZX与水反应放出气体的化学方程式为 。
(6)熔融状态下;Z的单质和FeG2能组成可充电电池(装置示意图如下);反应原理为2Z+FeG2 Fe+2ZG
Fe+2ZG

放电时;电池的正极反应式为 ;充电时; (写物质名称)电极接电源的负极:该电池的电解质为
消毒剂在生产生活中有极其重要的作用,开发具有广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl﹣)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂.等物质的量的上述物质消毒效率最高的是 (填序号)。
| A.Cl2 | B.H2O2 | C.ClO2 | D.O3 |
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称.如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O+H2O2═A+NH3↑,则生成物A的化学式为 ,H2O2被称为“绿色氧化剂”的理由是 。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年.亚氯酸不稳定可分解,反应的离子方程式为HClO2 → ClO2↑+H++Cl﹣+H2O(未配平)。在该反应中,当有1mol ClO2生成时转移的电子个数约为 。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是 (用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式 。
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4氧化Fe2+的离子方程式补充完整:

(3)已知:
生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的:
(4)己知:一定条件下,MnO4 - 可与Mn2+反应生成MnO2,
① 向 Ⅲ 的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是 .
② Ⅳ 中加入MnSO4的目的是
氮化硼(BN)是一种重要的功能陶瓷材料,请回答下列问题:
(1)基态B原子的电子排布式为___________;B和N相比,电负性较大的是_________,BN中B元素的化合价为___________;
(2)在BF3分子中,F-B-F的键角是___________,B原子的杂化轨道类型为___________;BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_____________;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为__________,层间作用力为__________;
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼晶胞,其结构与金刚石相似, 硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有__________个氮原子、____________个硼原子,立方氮化硼的密度是___________g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
二元弱酸是分步电离的,25时碳酸和草酸的 如下表:
如下表:
| H2CO3 |
Ka1=4.3×10-7 |
H2C2O4 |
Ka1=5.6×10-2 |
| Ka2=5.6×10-11 |
Ka2=5.42×10-5 |
(l)设有下列四种溶液:
A.0.1 mol/L的Na2C2O4溶液 B.0.1 mol/L的NaHC2O4溶液
C.0.1 mol/L的Na2CO3溶液 D.0.1 mol/L的NaHCO3溶液
其中,c(H+)最大的是_________,c(OH-)最大的是_________ 。
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示。

刚开始滴入碳酸钠溶液时发生反应的离子方程式为 ,BC段发生反应的离子方程式为 ,D点时混合溶液中由水电离产生的c(H+)="_________" mol/L。
(10分)常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: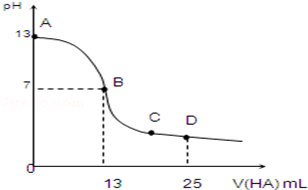
(1)写出MOH的电离方程式:__________________
(2)MOH与HA恰好完全反应时,溶液呈________性(填“酸”、“碱”或“中”),理由是(用离子方程式表示):__________;此时,混合溶液中由水电离出的c(H+)_________0.2mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”).
(3)写出B点,混合溶液中各离子浓度的大小关系B点____________.
(4)D点时,溶液中c(A﹣)+c(HA)__________2c(M+)(填“>”、“<”或“=”).
(12分)在一定温度下,有a盐酸,b硫酸,c醋酸三种酸.(用a、b、c填空)
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是__________.
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是__________.
(3)当三者c(H+)相同时,物质的量浓度由大到小的顺序为__________.
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是__________.
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),反应所需时间的长短关系是__________.
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是__________.
研究燃料的燃烧和对污染气体产物的无害化处理,对于防止大气污染有重要意义.
(1)将煤转化为清洁气体燃料.已知:
H2(g)+1/2O2(g)=H2O(g) △H=﹣242.0kJ/mol
C(s)+1/2O2(g)=CO(g) △H=﹣110.0kJ/mol
①写出焦炭与水蒸气反应制H2和CO的热化学方程式 ___________________.
②已知在101kPa时,CO、H2和CH4的燃烧热分别为283kJ/mol、286kJ/mol和892kJ/mol.则反应CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H= kJ/mol.
(2)已知一定温度和压强下,由H2和CO反应合成优质燃料甲醇:
CO(g)+2H2(g)⇌CH3OH(g) △H=﹣91kJ/mo1
①在相同条件下要想得到182kJ热量,加入各物质的物质的量可能是 .
| A.2mo1CO和4mol H2 |
| B.2mo1CO、4mol H2和1mol CH3OH(g) |
| C.4mo1CO和4mol H2 |
| D.4mo1CO和6mol H2 |
②将1mol CO和2mol H2充入一密闭容器中,保持恒温恒压时进行反应,达到平衡时,测得CO的转化率为20%.若在相同条件下,起始时在该容器中充入1mol CH3OH(g),反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量.