化学与人类社会可持续发展密切相关,能源、环境、工业生产以及日常生活等都离不开化学。
(1)大量使用化石燃料,最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关。为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式________________________;国际上最新采用“饱和亚硫酸钠溶液吸收法”,请写出有关反应的化学方程式_______________________。
(2)氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式______________。实验室可利用如右图所示装置完成该反应,在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是____________________。
(3)三硅酸镁(Mg2Si2O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_______________。将0.184 g三硅酸镁加到50 mL 0.1 mo1·L-1盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用 0.1 mo1·L-1NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O的n值为____________。(注:Mg2Si3O8的摩尔质量为260 g·mol-1)
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式___ 。
(2)已知:Se + 2H2SO4(浓) → 2SO2↑ + SeO2 + 2H2O
2SO2 + SeO2 + 2H2O → Se + 2SO42-+ 4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是_____________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2 + KI + HNO3 → Se + I2 + KNO3 + H2O ② I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
配平方程式①,标出电子转移的方向和数目。______________________。
(4)实验中,准确称量SeO2样品0.1500 g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为_____________。
高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:

已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
| 沉淀完全的pH |
3.7 |
9.7 |
(1)操作①加快反应速率的措施有 (写一种)。碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为________________。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
以下是利用主要成分为Cu2S和Fe2O3的工业废弃固体(其他成分不参与反应)制备有关物质,实验流程如图所示:

回答下列问题:
(1)气体X的化学式为 。
(2)加入铁粉时发生反应的离子方程式为:2H++Fe Fe2++H2↑、 。
Fe2++H2↑、 。
(3)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量绿矾后随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O、 。
(4)除杂时需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,则氧化剂及试剂Y可以是 (填编号)。
a.H2O2、CuO b.HNO3、Cu(OH)2
c.KMnO4、CuCl2 d.漂白粉、CuCO3
(5)无水硫酸铜受热分解生成氧化铜和气体,受热温度不同气体可能为SO3、SO2和O2中的一种、两种或三种。现设计如下实验测定产生的SO2、SO3和O2的物质的量,并计算各物质的化学计量数,从而确定CuSO4分解的化学方程式(已知实验结束时,硫酸铜完全分解)。

①仪器C的名称是 。
②组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
①→⑨→⑩→⑥→⑤→ → → → →②(填接口序号)。仪器F的作用是 。
③若某小组称取6.4g无水CuSO4,实验过程中装置C增加的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,请通过计算确定实验条件下CuSO4分解的化学方程式: 。
有报道称Co3O4能催化N2O分解,其中27Co在元素周期表中属于铁系元素,其单质及化合物的性质与铁有很多相似之处。
(1)钴元素在周期表中的位置是 ;Co3O4中Co的化合价为 。
(2)Co3O4能与浓盐酸反应生成黄绿色气体,写出反应的化学方程式: 。实验反应中若消耗10mol·L-1浓盐酸40mL,则反应中转移电子 mol,产生气体的标准状况下体积为 mL。
(3)下列关于Co3O4催化N2O分解的说法正确的是 (填序号)。
A.Co3O4作为催化剂使N2O分解反应的 增大
增大
B.Co3O4作为催化剂使N2O分解反应的 减少
减少
C.Co3O4作为催化剂使N2O分解反应的 不变
不变
D.Co3O4作为催化剂使N2O分解反应的途径改变,降低了反应所需能量
E.Co3O4作为催化剂使N2O分解反应的途径改变,增加了反应所需能量

(4)实验测得:Co(OH)2在空气中加热时,可得到不同价态的氧化物。固体残留率(剩余固体质量与原始固体质量比率)随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水。通过分析数据确定:在B、C之间(500℃—1000℃)范围内,剩余固体成分为: 。
NaCl是一种化工原料,可以生产一系列物质(见下图)。
(1)25℃,NaHCO3在水中的溶解度比Na2CO3的_____(填“大”、“小”或“不能确定”)
(2)已知氯化钠在25℃的溶解度为36g,则该温度下饱和氯化钠的质量分数为______(计算结果保留一位小数)。
(3)碳酸氢钠受热分解的化学方程式是_______
(4)用氯气生产氯化氢的化学方程式是________
(5)食盐水通电后发生反应的离子方程式是_______
亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:

已知:
①纯ClO2易分解爆炸,空气中ClO2 的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A 可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2) 反应Ⅱ的离子方程式为_________。
(3) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是____________。
(5) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2和CO2。若处理含NaCN4×10-5mol ·L-1的废水 1000L,至少需要ClO2的质量为___________g。
五氯化磷(PCl5)是有机合成中重要的氯化剂,可以有三氯化磷(PCl3)氯化得到: 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如下表所示:
。某温度下,在容积恒定为2.0L的密闭容器中充入2.0molPCl3和1.0molCl2,一段时间后反应达平衡状态,实验数据如下表所示:
(1) 0~150s内的平均反应速率
(2) 该温度下,此反应的化学平衡常数的数值为___________(可用分数表示)。
(3) 反应至250s 时,该反应放出的热量为______________kJ。
(4) 下列关于上述反应的说法中,正确的是__________(填字母序号)。
a. 无论是否达平衡状态,混合气体的密度始终不变
b. 300s 时,升高温度,正、逆反应速率同时增大
c. 350s 时,向该密闭容器中充入氮气,平衡向正反应方向移动
d. 相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.2molCl2,达到化学平衡状态时,n(PCl5 ) < 0.20mol
(5) 温度T 1时,混合气体中PCl5 的体积分数随时间t 变化的示意图如下。其他条件相同,请在下图中画出温度为T 2(T 2> T 1)时,PCl5的体积分数随时间变化的曲线。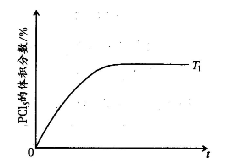
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:
FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
下表为元素周期表的一部分,其中编号代表对应的元素。

请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的电子排布图为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式 ,(写出一种即可)其VSEPR构型为 。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中, 的配位数为 。
的配位数为 。
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1m ol(SCN)2分子中含有共价键的数目为 。
铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为 (用含“a、NA的代数式表示)g· 。
。

合成氨是最重要的化工生产。

(1)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 决定。

(2)合成氨反应N2(g)+3H2(g)=2NH3(g),使用催化剂反应的△H (填“增大”“减小”或“不改变”
(3)合成氨盐也是氨的重要用途,测定其中的含氮量可以采用“甲醛法”。即

 现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2克该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL,浴液,取出10mL,滴人酚酞后再逐滴滴入
现有一种纯净的铵盐,可能是硝酸铵、硫酸铵或碳酸铵中的一种。称取2克该铵盐溶于水,加入足量的甲醛溶液后,再加入水配成100 mL,浴液,取出10mL,滴人酚酞后再逐滴滴入 溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是 。
溶液,当滴到25 mL时溶液呈粉红色,且在半分钟内不褪色,则该铵盐中氮的质量分数是 。
(4 )拆开 1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,写出N2+3H2 2NH3反应的热化学方程式 ,
2NH3反应的热化学方程式 ,
I 铁及其化合物之间的相互转化可用下式表示:

回答下列有关问题:
(1)检验硫酸铁溶液中是否存在Fe2+的方法是___________________。
(2)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2 = 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是___________,每生成l mol Na2FeO4转移____________mol电子。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:
Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:_______________。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为___________。
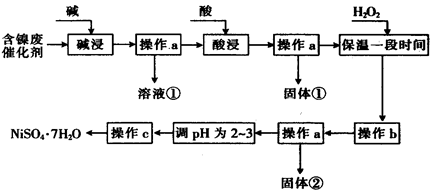
II某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备 。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下:
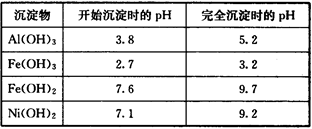
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是 (填化学式)。
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是
(5)NiS04·7Hz0可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为 。
Reformatsky反应是利用醛与卤代酸酯反应制备羟基酸酯的常用简便方法,是形成碳碳健重要的有机反应。反应如下:

(1)化合物(Ⅰ)的一种同分异构体满足下列条件:①含有苯环;②核磁共振氢谱有4个峰,峰面积之比为1:2:2:3,其结构简式为 。
(2)化合物(Ⅲ)的分子式为 ,1mol该物质完全燃烧最少需要消耗 molO2.
(3)化合物(Ⅱ)所含官能团是 (名称),其在加热条件下与NaOH溶液反应的化学方程式是 。
(4)一定条件下, 与过量的
与过量的 也可以发生Reformatsky反应,试写出该生成物的结构简式 。
也可以发生Reformatsky反应,试写出该生成物的结构简式 。
A、B、C、D、E、R六种元素位于周期表的前四周期,其原子序数依次增大。已知A原子核外有三个未成对电子;B的最外层电子数是内层电子数的3倍;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;R原子核外最外层电子数与C相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D四种原子的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)C的氯化物的熔点比D的氯化物的熔点高,理由是 。
(3)基态R+离子的核外电子排布式是 。
(4)Q分子是A2B的等电子体,Q的结构式为 。
(5)图一是R单质的晶胞结构,配位数为 ;图二是B、R两元素组成的一种化合物的晶胞,其化学式为 。

(1)侯德榜制碱法生产流程为:

①沉淀池中反应的化学方程式: ;
②检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
③上述流程中物质X的分子式为 。
(2)实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
四种盐在不同温度下的溶解度表 (g/100g水)

④反应控制在30—35℃,是因为高于35℃ NH4HCO3会分解,低于30℃则反应速率降低,为控制此温度范围,通常采取的加热方法为___________________;
⑤加料完毕,保温30分钟,目的 ;
⑥静置后只析出NaHCO3晶体的原因 ;
⑦过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 (填化学式)循环使用,回收得到NH4Cl晶体。