NaCl是一种化工原料,可以生产一系列物质(见下图)。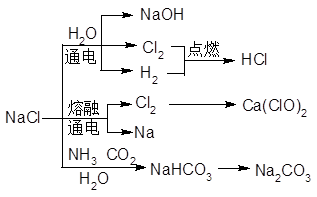
(1)25℃,NaHCO3在水中的溶解度比Na2CO3的_____(填“大”、“小”或“不能确定”)
(2)已知氯化钠在25℃的溶解度为36g,则该温度下饱和氯化钠的质量分数为______(计算结果保留一位小数)。
(3)碳酸氢钠受热分解的化学方程式是_______
(4)用氯气生产氯化氢的化学方程式是________
(5)食盐水通电后发生反应的离子方程式是_______
NaCl是一种化工原料,可以生产一系列物质(见下图)。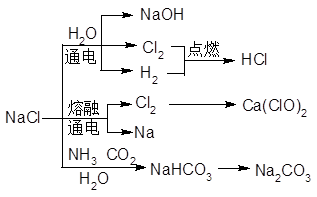
(1)25℃,NaHCO3在水中的溶解度比Na2CO3的_____(填“大”、“小”或“不能确定”)
(2)已知氯化钠在25℃的溶解度为36g,则该温度下饱和氯化钠的质量分数为______(计算结果保留一位小数)。
(3)碳酸氢钠受热分解的化学方程式是_______
(4)用氯气生产氯化氢的化学方程式是________
(5)食盐水通电后发生反应的离子方程式是_______