明胶是水溶性蛋白质混合物,溶于水会形成胶体。工业明胶制成的胶囊中往往含有超标的重金属Cr,因而对人体造成伤害。
(1)用一束光照射明胶水溶液,可观察到_________现象。
(2)Na2CrO4是工业中常用的氧化剂,工业上可用FeCr2O4(Cr元素的化合价为+3)制Na2CrO4,其反应为4FeCr2O4+8Na2CO3+7O2==8Na2CrO4+2Fe2O3+8CO2。
①FeCr2O4中铁元素的化合价为_______,用氧化物的形式表示FeCr2O4的化学式:________。
②该反应的氧化产物是________;每生成1mol Na2CrO4时,转移电子_____mol。
已知Si与NaOH溶液反应的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑。
(1)将等物质的量的下列物质投入到足量的烧碱溶液中,完全反应放出气体最多的是()
| A.硅 | B.铝 | C.钠 | D.铁 |
(2)将9.2 g钠和4.2 g硅同时投入到过量冷水中,充分反应后,在标准状况下,能生成氢气的体积是 L。
向盛有10滴0.1mol/L AgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成,再向其中滴加0.1mol/L KI溶液,观察到 ;然后向其中滴加0.1mol/L Na2S溶液,又观察到 。
净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层.外层的优氯净 Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去.
(1)优氯净中氯元素的化合价为 .
(2)亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 .
(3)亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 .
根据要求回答下列各题:
Ⅰ.现有①Na2O ②SO3 ③铁 ④蔗糖 ⑤冰醋酸(纯醋酸晶体) ⑥KNO3晶体 ⑦氢氧化钠溶液等物质,请填空回答(填序号):
以上物质在常温下(1)能导电的是 ;
(2)属于非电解质的是 ;
(3)属于电解质的是 。
Ⅱ.离子反应为中学化学中重要反应类型,在发生离子反应的反应物或生成物中,一定存在下列________(填序号)
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(1)MgCl2的摩尔质量是 ;0.1mol CO2在标准状况下体积约是 ;0.2 mol·L-1的Cu(NO3)2溶液中NO3-的物质的量浓度是 。
(2)现有以下物质:①熔融NaCl ②液氨 ③醋酸水溶液 ④HCl气体 ⑤酒精(C2H5OH)。请用相应序号填空:能导电的是 ;属于电解质的是 。
(3)CH3COOH的电离方程式为 。
下表给出了ABCDE五种有机物的有关信息
请根据表中信息回答下列问题:
(1)将A通入到少量的溴的四氯化碳溶液中,主要现象是____________________。
(2)B分子的空间构型为___________________。
(3)实验室用C制取少量的A的反应条件为:以浓硫酸作催化剂、温度为_______℃。
(4)C与E发生反应的化学方程式为_______________________________。
(5)D与新制的氢氧化铜的悬浊液反应的化学方程式为___________________________。
(6)E的一种同分异构体F既能在NaOH溶液中发生水解反应,又能与银氨溶液反应,则F的结构简式为______________________。
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图
假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
无机化合物可根据其组成和性质进行分类:
(1)下图所示的物质分类方法名称是________________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ②_______ |
③_______ ④Ba(OH)2 |
⑤Na2CO3 ⑥________ |
⑦CO2 ⑧Na2O2 |
(3)写出⑦转化成⑤的化学方程式________________________。
(4)呼吸面具中用⑧作为O2来源的反应原理为:______________________。
(5)实验室制备⑦常用_______和_________反应,检验该气体的方法是______________________。
钠、铝、碳、硅是四种常见的化学元素。请回答下列问题:
(1)五种元素中,原子半径最大的是_________(填元素符号),单质广泛用作半导体材料的是______(填化学式)。
(2)铝在周期表中位于第________周期第________族,氧化铝在另三种元素之一的最高价氧化物对应的水化物溶液中可溶解,写出反应的离子方程式:____________。
(3)工业上由下列物质冶炼相应金属时与冶炼铝采用相同方法的是________(填选项代号)。
| A.Fe2O3 | B.MgCl2 | C.NaCl | D.HgO |
(4)生产上常利用金属铝与Fe2O3在高温下的反应来进行焊接钢轨,请写出该反应的化学方程式:______。
(1)过氧化钠可用于呼吸面具或潜艇中的氧气来源,则人呼出的气体与过氧化钠反应的化学方程式为: 、 。
(2)新生成的氢氧化亚铁在空气中会迅速变灰绿色、最后变为红褐色,其化学方程式为: 。
(3)铝制餐具长时间存放酸性、碱性或咸的食物,就会受到腐蚀。其中碱性食物与铝制品的氧化膜发生反应的离子方程式为 。
(1)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的正极反应式为________________。
②为了降低某水库的铁闸门被腐蚀的速率,可以采用如图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_________________。
| A.铜 | B.锡 | C.锌 | D.石墨 |
③如图乙方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的__________极上。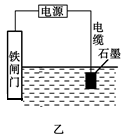
(2)根据反应Fe+Fe2(SO4)3=3FeSO4设计的双液原电池如图所示。
①电极Ⅰ的材料为金属铁,则烧杯A中的电解质溶液为______________(填化学式)。
②电极Ⅱ发生的电极反应式为___________________。
(3)某同学组装了如图所示的电化学装置。电极Ⅰ为Al,其他电极均为Cu。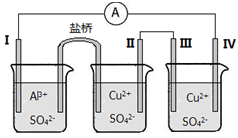
①电极Ⅰ为_________极(填“正”“负”或“阴”“阳”),发生___________反应(填“氧化”或“还原”),电极反应式为_______________;电极Ⅲ为_______________极(填“正”“负”或“阴”“阳”)。
②盐桥中盛有含KNO3溶液的琼脂,盐桥中的K+向_____________极(填“Ⅰ”或“Ⅱ”)移动。
装置甲、乙、丙的烧杯中都盛有稀硫酸。
(1)装置丙中的Fe电极上的反应式:____________________。
(2)装置乙中被腐蚀的金属是________________(填元素符号),比较装置甲、乙、丙中纯铁被腐蚀的速率由快到慢的顺序是_____________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图丁。请回答:
A电极对应的金属是____________(写元素名称),B电极的电极反应式是______________________。
镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因_____________________。
25℃时,50mL0.10mol/L的醋酸中存在平衡:CH3COOH CH3COO-+H+。若分别作如下改变,对上述平衡有何影响?
CH3COO-+H+。若分别作如下改变,对上述平衡有何影响?
(1)加入少量0.10mol/L盐酸,平衡将向__________(填“向右移动”、“向左移动”或“不移动”),溶液中c(H+)将________________(填“增大”、“减小”或“不变”)。
(2)加入少量冰醋酸,平衡将向___________(填“向右移动”、“向左移动”或“不移动”),醋酸的电离程度将________________(填“增大”、“减小”或“不变”)。
在某温度时,在2L容器中X、Y、Z三种气体物质的量随时间的变化关系曲线如图所示。
(1)由图中的数据分析,该反应的化学方程式为_____________。在该温度下,此化学反应的平衡常数表达式为_______________。
(2)反应开始至5min,Y的转化率为____________。
(3)在其他条件不变的情况下,如果起始充入X、Y、Z的物质的量分别为4mol、6mol、2mol,则此反应向___________(填“正反应”,“逆反应”)方向进行。