(1)在某压强恒定的密闭容器中加入2 molN2和4 molH2发生如下反应:
N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
2NH3(g);ΔH=-92.4 kJ/mol,当反应建立平衡时,此时容器体积为反应前的三分之二。则:
①达到平衡时,N2的转化率为___________。
②若向该容器中加入a mol N2、b mol H2、c mol NH3,在相同条件下达到平衡时,混合物中各组分的百分含量与上述平衡相同,则a 、b、c应满足的关系为 。
(2)若将2 molN2和4 molH2放入起始体积相同的恒容容器中,在与(1)相同的温度下达到平衡,则平衡时NH3的浓度 (1) (2) (填“>”、“<”或“=”)。
(3)常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10mol/L HCl溶液和20.00 mL 0.10 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示: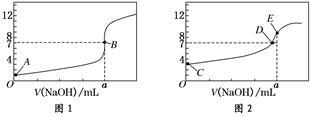
①NaOH溶液滴定HCl溶液的曲线是 (填“图1”或“图2”);
②图中c(Na+)=c(CH3COO-)的点是 (填A、B、C、D或E);
③滴定结束,经数据处理后发现a大于20.00ml,请你分析该同学测定a值偏大的原因可能是 。
(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=____________.(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH________7(>、≥ 、=、<)。
②若溶液pH>7,则c(Na+)________c(A-),理由是________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是______(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
硅是重要的无机非金属材料,工业上从硅的氧化物制取硅单质的主要反应为
SiO2 + 2C Si + 2CO↑。其中,氧化剂是 (填化学式),被氧化的物质是 (填化学式),若反应中消耗了2 mol C,则转移的电子为 mol 。
Si + 2CO↑。其中,氧化剂是 (填化学式),被氧化的物质是 (填化学式),若反应中消耗了2 mol C,则转移的电子为 mol 。
按要求书写相关反应的化学方程式:
(1)硫在氧气中燃烧______________________。
(2)在汽车的排气管上装一个催化转化装置,可以治理汽车尾气中的NO和CO,其原理是________
(3)氨的催化氧化________________________。
(4)制取漂白粉__________________________。
(5)工业合成氨__________________________。
工业上以废铜为原料经一系列化学反应可生产氯化亚铜(CuCl),其工艺流程如图所示:
试根据如图转化回答下列问题:
(1)工业生产Cl2时,尾气常用石灰乳吸收,而不用烧碱溶液吸收的原因是__________。
(2)还原过程中的产物为Na[CuCl2],试写出反应的化学方程式__________,制备中当氯化完成后必须经还原过程再制得CuCl,为什么不用一步法制得CuCl?(已知Cu2++Cu+2Cl-═2CuCl↓) __________。
(3)还原过程中加入少量盐酸的作用是__________,加入NaCl且过量的原因是__________。
(4)合成结束后所得产品用酒精淋洗的目的是__________。
(5)实验室中在CuCl2热溶液中通入SO2气体也可制备白色的CuCl沉淀,试写出该反应的离子方程式__________。
胃酸过多是常见的胃病,下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;④遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后多见胃胀气,甚至有引起胃溃疡穿孔的危险;(6)焰色反应为黄色。
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;②凝胶本身覆盖于溃疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是______________(填化学式,下同);乙中含有的主要化学成分是______________。
(2)试写出甲中含有的主要化学成分引起胃胀气的离子方程式 ___
(3)试写出乙溶于NaOH溶液的离子方程式 。
Na、NaOH、Fe2O3、FeCl3是中学化学常见的四种物质,请依据这些物质回答下列问题。
(1)钠可以和TiCl4反应制取金属Ti,体现钠的___________性。将一小块金属钠投入水中,反应的离子方程式为______________,能说明钠的密度比水小的现象是__________。
(2)氯碱工业是利用实验溶液电解制取烧碱和氯气,其反应为:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑,
2NaOH+Cl2↑+H2↑,
该反应的离子方程式为__________________;氯气有毒,可以用_____________吸收。
(3)写出Fe2O3的一种用途_____________,请设计实验证明赤铁矿中含有铁元素______________。
(4)电子工业常用FeCl3溶液刻蚀印刷电路板(由高分子材料和铜箔复合而成),化学方程式为___________。
我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。
(1)用双桥法标出电子转移的方向及数目
S+2KNO3+3C = K2S+N2↑+3CO2↑
(2)该反应中还原剂是 ,氧化剂是 。
合成尿素的反应为: 完成下列填空:
完成下列填空:
(1)写出NH3的电子式 ;画出碳原子结构示意图 ;氧元素位于周期表第 周期第 族。
(2)上述反应所涉及的4种元素,原子半径从大到小的排列顺序为 。
(3)上述反应所涉及的4种元素中,非金属性最强的是 。
(4)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中水蒸气0.6mol,则平均反应速率v(NH3)= mol/(L·min)。
(5)下列能说明上述反应己达平衡的是 。(填序号)
a.2c(NH3)=c(H2O)b.CO2的浓度不变
c.v正(NH3):v正(CO2)=2:1 d.气体的压强不变
(6)为提高氨气的转化率,工业上用该反应生产尿素时,合适的反应条件是 。(填序号)
a.200℃ b.800℃ c.101kPa d.24000kPa
过氧化碳酰胺(CO(NN2)2·H2O2)是一种白色晶体,易溶于水和有机溶剂,稍高温度时(>45℃)即分解,可作为高效、安全、方便的固体消毒剂。工业上常用湿法合成,工艺流程如下: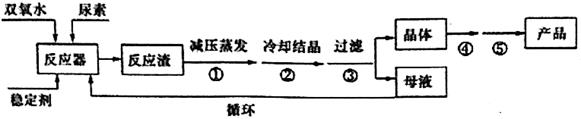
(1)反应器中发生的反应为:CO(NH2)2+H2O2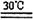 CO(NN2)2·H2O2 △H <0,应采取_______方式加热,从母液中循环利用的物质为________。
CO(NN2)2·H2O2 △H <0,应采取_______方式加热,从母液中循环利用的物质为________。
(2)操作①采用减压蒸发的原因是________,操作④、⑤名称为________、________。
(3)过氧化碳酞胺也可用干法流程制取: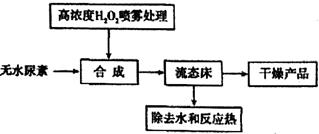
与湿法工艺对比,干法工艺的优点是________,缺点是________。
(4)为测定产品的纯度,称取3.0 g产品于锥形瓶中,加适量蒸馏水溶解,再加入几滴H2SO4,用0.2500 mol/L KMnO4标准溶液滴定,终点时消耗标准溶液40.00 mL〔己知:尿素与KMnO4溶液不反应)。
①完成并配平方程式:______MnO4-+______H2O2+ ______H+=_______Mn2 ++_____H2O+______
②产品纯度为________(结果保留到小数点后一位)。
科学家利用“组合转化”等技术对CO2进行综合利用。如用H2和CO2在一定条件下可以合成乙烯:6H2 (g) +2 CO2 (g)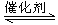 CH2=CH2 (g) +4H2O (g) △H="a" kJ/mol
CH2=CH2 (g) +4H2O (g) △H="a" kJ/mol
(1)己知:①H2和CH2=CH2的燃烧热分别为285.8kJ/mol和1411kJ/mol
②H2O (g)=H2O(1) △H="=-" 44 kJ/mol,则a="________" kJ/mol
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是________ (填序号)。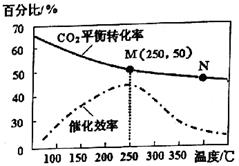
①M点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④为提高CO2的转化率应在尽可能低的温度下进行反应
(3)若在密闭容器中充入体积比为3:1的H2和CO2,则图中M点时,产物CH2=CH2的体积分数为________;若要进一步提高乙烯的体积分数,可采取的措施有________。
(4)科学家开发了一种新型陶瓷(主要成分为Li4SiO4 ),在500℃时可高效吸收CO2,同时生成Li2CO3;该材料在700℃时可再生循环。请写出表示该过程的化学方程式________。
(5)利用高温电解技术可将CO2转化为高热值的燃料CO: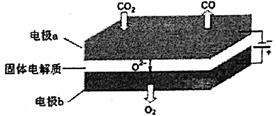
①电极a发生________ (填“氧化”或“还原”)反应。
②高温电解的总反应的化学方程式为________。
某化工厂尝试用软锰矿、闪锌矿(含有Fe、Cu、 Al等元素杂质)联合制备工业产品MnO2和Zn。(已知:软锰矿的主要成分为MnO2,闪锌矿主要成分为ZnS。)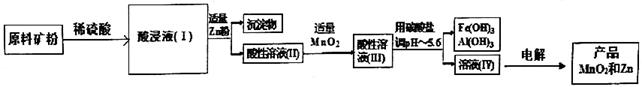
(1)原料需加工成矿粉的原因是________。
(2)己知MnO2有较强的氧化性,在酸性溶液中能氧化金属硫化物生成硫单质,请写出原料矿粉加稀硫酸后所发生的主要反应________。
(3)酸浸液(I)中含有的金属阳离子有Mn2+、Fe3+、Zn2+、________、________。
(4)酸性溶液(II)中加入适量MnO2的作用是________;酸性溶液(Ⅲ)中所加的碳酸盐可选用________ (填序号)。
①Na2CO3 ②MnCO3 ③ZnCO3 ④CaCO3
(5)电解溶液Ⅳ后阳极产物为________,若电解过程转移lmol电子,则理论上阴极产物的质量为________g。
化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等离不开化学。
(1)普通玻璃是常见的硅酸盐产品,其化学式为Na2CaSi6O14,以氧化物形式可表示为_________;铝制品表面因有一层氧化铝薄膜而经久耐用,但该氧化膜易被酸、碱破坏。若将氧化铝与氢氧化钠溶液作用,反应的离子方程式为_______________________。
(2)氯气用于漂白时,实际上起漂白作用的物质不是Cl2而是它和水反应生成的__________(写化学式)。缺铁性贫血患者补充的铁,通常以硫酸亚铁的形式;而硫酸铁则没有这种药效。当用硫酸亚铁制成药片时外表要包有一层特殊的糖衣,这层糖衣的作用是___________。
(3)从降低成本和减少环境污染的角度考虑,制取硫酸铜最好的方法是__________(填选项字母)。
| A.铜和浓硫酸反应 | B.铜和稀硫酸反应 |
| C.氧化铜和硫酸反应 | D.铜与Fe(SO4)3溶液反应 |
按要求完成下列问题:
(1)甲基的电子式 。
(2)相对分子质量为72且沸点最低的烷烃的结构简式为 。
(3) 名称是 。
名称是 。
(4)松油醇( )的官能团的名称为 。
)的官能团的名称为 。
(5)写出方程式:实验室制乙炔 。
(6)写出方程式:甘氨酸(H2NCH2COOH)的缩聚反应 。
(7)写出方程式: 形成六元环酯的反应 。
形成六元环酯的反应 。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度/(mol·L-1) |
NaOH物质的量浓度/(mol·L-1) |
混合溶液的pH |
| 甲 |
c |
0.2 |
pH=7 |
| 乙 |
0.2 |
0.1 |
pH>7 |
| 丙 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,c是否一定等于0.2________(选填“是”或“否”)。
(2)单从乙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是_______________。
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA) =_________mol/L。