乳酸分子式为C3H6O3,在一定的条件下可发生许多化学反应,下图是采用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物。(已知—OH,—COOH等为亲水基团,F常做内燃机的抗冻剂)请回答相关问题:
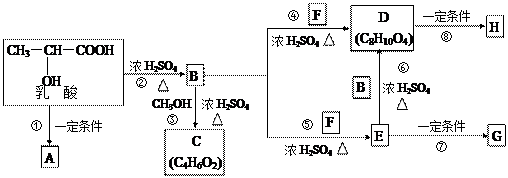 |
(1)推断C、F的结构简式。C: ;F: 。
(2)B中所含的官能团有 ;反应③的反应类型是 。
(3)反应①的化学方程式为 。
(4)作为隐形眼镜的制作材料,对其性能的要求除应具有良好的光学性能外,还应具有良好的透气性和亲水性。一般采用E的聚合物G而不是D的聚合物H来制作隐形眼镜,其主要理由是
。
写出与下列每一个离子方程式对应的一个化学反应方程式:
(1)CO32-+2H+=H2O+CO2↑:。
(2)H++OH-=H2O:。
(3)Mg+2H+=Mg2++H2↑:。
(4)BaCO3+2H+=Ba2++H2O+CO2↑:。
有下列离子:K+、Mg2+、Ba2+、Na+、SO2-4、OH-、NO-3、Cl-等。按其在溶液中可大量共存的原则,将上述离子等分成两组(要求每组不少于两种阳离子和两种阴离子),则两组分别是______________________________,__________________________。
往平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O ]与氯化铵[NH4Cl]晶体,塞紧瓶塞。在木板上滴少量水,如下图所示。一会儿,就发现瓶内固态物质变成液体,瓶塞变冷,小木板上因少量水冻结而把烧瓶粘住,这时打开瓶塞,放出的气体有氨气的气味。这是自发的发生了吸热反应:。这个现象说明下列结论正确的是
| A.自发反应一定是吸热反应 | B.自发反应一定是放热反应 |
| C.有的吸热反应也能自发进行 | D.吸热反应不能自发进行 |

摩尔熵是单位物质的量的物质在一定条件下所具有的熵。通过已有的知识,试判断下列两组物质的摩尔熵的大小顺序:
⑴相同条件下的气态甲醇、乙醇、丙醇。
⑵气态苯、液态苯、故态苯。
如图所示,水槽中试管内有一枚铁钉,放置数天观察:
⑴铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。
⑵若试管内液面上升,则原溶液是性,发生腐蚀,电极反应:负极:,正极:。
⑶若试管内液面下降,则原溶液是性,发生腐蚀,电极反应:负极:,正极:。
⑷若溶液甲为水,溶液乙为海水,则铁钉在(填“甲”或“乙”)溶液中腐蚀的速度快。
现在工业上主要采用离子交换膜法电解饱和食盐水制取NaOH、H2和Cl 2。请回答下列问题:
⑴在电解过程中,与电源正极相连的电极上所发生的电极反应式为 。
⑵电解之前,食盐水需要精制,目的是除去粗盐中的、Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为(填试剂序号) 。
⑶如果在容积为10L的离子交换膜电解槽中,1min后在阴极可产生11.2L(标准状况)Cl2,这时溶液的pH值是 (填“升高”、“降低”或“不变”),溶液中c(OH-)为(设体积保持不变) 。
⑷若没有阳离子交换膜的存在,则电解饱和食盐水的化学方程式是
。
X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气), Y+Z→B(气)。请针对以下两种不同情况回答:
⑴ 若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
① Y的化学式是_______;② 生成固体C的化学方程式是____________。
⑵ 若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
① B的化学式是_____;② 向苛性钠溶液中通入过量的A,所发生反应的离子方程式________________; ③ 将Y与⑴中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是________________。
同浓度的下列溶液中NH4+的浓度的由大到小顺序为
①NH4HSO4②(NH4)2SO4③(NH4)2Fe(SO4)④NH4HCO3⑤(NH4)2CO3
(福建省漳州市芗城中学2009届高三一轮复习单元测试,化学,25)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液。应量取盐酸体积_______mL,应选用容量瓶的规格_________mL。除容量瓶外还需要的其它仪器_________________________________。
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____________________
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3) 操作A中,将洗涤液都移入容量瓶,其目的是
。溶液注入容量瓶前需恢复到室温,这是因为
。
(4)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响)?
a.没有进行A操作__________;b.加蒸馏水时不慎超过了刻度________;c.定容时俯视____________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度? __________________。
向容量瓶中转移溶液时(实验步骤B) 不慎有液滴掉在容量瓶外? _______ _______。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是___________________。
②红磷充分燃烧的产物与NaOH溶液反应的离子方程式是 ____________________________________________________________________。
③步骤c滴入稀硝酸后烧杯中的现象是_____________________________________
______________________________________________________________________。反应的离子方程式是____________________________________________________。
2008年诺贝尔化学奖授予日本科学家下村修、美国科学家马丁·沙尔菲与美籍华裔科学家钱永健,以表彰三人因在发现和研究绿色荧光蛋白方面做出的贡献。蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量(质量分数约在14%--18%),蛋白质是人体重要营养物质之一,2008年9月“三鹿牌婴幼儿奶粉事件”中,由于在低蛋白含量的奶粉中加入三聚氰胺来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。三聚氰胺目前由尿素加热分解制得,生产成本价廉,三聚氰胺的结构如图所示。
食品中蛋白质含量的现行国家标准和国际通行测定方法是经典凯氏定氮法,其测定原理是:
Ⅰ.有机物中的氮在强热和CuSO4、浓H2SO4作用下,生成(NH4)2SO4
Ⅱ.(NH4)2SO4与碱作用,蒸馏释放出NH3,收集于H3 BO3溶液中,生成 (NH4)2B4 O7
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,再换算出蛋白质的含量。乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。
(1) 用尿素制备三聚氰胺的化学方程式为: _________________________。
上述原理第Ⅱ步生成(NH4)2B4 O7的离子方程式为:_________________________。
(2)凯氏定氮法在测定奶粉中蛋白质含量时,为什么会失真?
__________________________________________________。
(3)下列关于三聚氰胺的说法中,正确的有_____;
| A.三聚氰胺是一种白色结晶粉末,没有气味,所以掺入奶粉后不易被发现 |
| B.三聚氰胺属于芳香族化合物。 |
| C.三聚氰胺不溶于水,属于分子晶体 |
| D.三聚氰胺呈弱碱性,可以和酸反应生成相应的盐 |
E、三聚氰胺可以发生取代反应
F、三聚氰胺分子中所有原子可能在同一个平面上
G、1mol三聚氰胺可以与3mol氢气发生加成反应
(4)三聚氰胺含氮量(氮元素的质量分数)为____;假定奶粉中蛋白质含量为16%即为合格,三鹿牌婴幼儿配方乳粉抽查结果显示其三聚氰胺含量为2563.00mg/kg,三鹿牌婴幼儿配方乳粉蛋白质含量实际上是____;掺假百分率为____。
中学有机化学中同学常碰到关于乙醛和溴反应的问题,对此同学常有如下不同的观点:
①乙醛中醛基有强还原性,而溴单质(Br2)有强氧化性,因而两者可发生氧化还原反应。
②乙醛分子中羰基含有碳氧双键,因而可和Br2发生加成反应。
③乙醛分子中的烃基可和溴发生取代反应。
为此,某同学进行如下实验,并记录了相关实验事实:
实验1:在1mL Br2的CCl4溶液中加入1mL乙醛,发现溶液分层,下层橙黄色,上层无色溶液无明显现象。
实验2:在1mL饱和的溴水中加入1mL乙醛,振荡试管后静置,发现溶液不分层,且发现溴水褪色。
1.根据以上实验1,2及相关实验事实,请你对乙醛和溴的反应原理作出相应的分析:
(1)根据实验1,可推知
(2)根据实验2,可推知
2.目前有一个较为典型的试题是:
“已知柠檬醛的结构简式为(CH3)2C=CHCH2CH2CH=CHCHO,如何检验出其中的C=C双键?”通常的实验方法是:“先加足量的银氨溶液[或新制的Cu(OH)2],取上层清液加酸中和后,然后再用酸性KMnO4溶液(或溴水)检验C=C双键。”
(1)请分析该实验检验方法是否合理,为什么?
(2)根据以上提供的实验事实,是否有更为简便的检验方法?;如果有,请简单说明该实验方法;如果没有,则不必说明。
【江苏省无锡市2009届高三上学期期末调研考试】苯佐卡因是一种局部麻醉剂,可用于粘膜溃疡、创面等的镇痛,一般制成软膏或栓剂使用,它的工业合成有如下所示的两种途径。途径I已逐渐淘汰,现在使用较多的是途径II。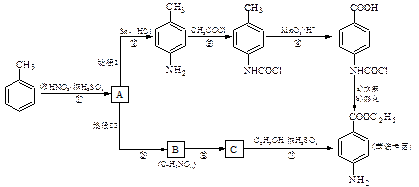
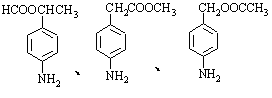
已知:①当苯环上连有甲基时,再引入的其他基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其他基团主要进入它的间位。
②苯胺(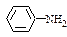 )分子中的氨基易被氧化。
)分子中的氨基易被氧化。
请回答下列问题:
(1)反应①的反应类型为______________,化合物B的结构简式为______________。
(2)反应⑦的化学方程式为__________________________________________________。
(3)下列关于上述合成路线的说法正确的是__________________。
a.反应①除了主要生成A物质外,还可能生成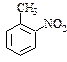 、
、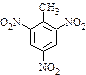 等
等
b.途径II中的步骤①和⑤可以互换
c.反应③的另一产物是H2O
d.与途径II相比,途经I的缺点是步骤多,产率低
e.途经I中的步骤③的目的是保护氨基不被步骤④中的酸性高锰酸钾溶液氧化
(4)途经II中的步骤⑤和⑥能否互换,说明理由:_________________________________。
(5)苯佐卡因有多种同分异构体。其中有两个对位取代基,-NH2直接连在苯环上,分子结构中含有酯基的同分异构体有:
__________________、_____ 。
[江苏省南通中学2008学年度第一学期期末复习高三化学 ].某化学课外活动小组研究乙醇氧化的实验并验证其产物,设计了甲、乙、丙三套装置(图中的夹持仪器均未画出,“△”表示酒精灯热源),每套装置又可划分为①、②、③三部分。仪器中盛放的试剂为:a-无水乙醇(沸点:78 ℃);b-铜丝;c-无水硫酸铜;d-新制氢氧化铜悬浊液。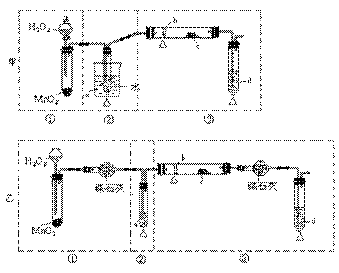
(1)简述两套方案各自的优点:甲:_________________、_________________________,
乙:___________________
(2)集中两套方案的优点,组成一套比较合理完善的实验装置,可按气流由左至右的顺序表示为________________(例如甲①,乙②)
(3)若要保证此实验有较高的效率,还需补充的仪器有__________。理由______。
(4)实验中能验证乙醇氧化产物的实验现象是_______________。
(5)装置中,若撤去第①部分,其它操作不变,则无水硫酸铜无明显变化,其余现象与(4)相同,推断燃烧管中主要反应的化学方程式____________。