铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加时,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为
| A.22.2% | B.75.7% | C.30.0% | D.80.6% |
若在加入铝粉能放出H2的溶液中分别加入下列各组离子,肯定不能大量共存的是
| A.Fe3+、SO42-、C1-、Na+ |
| B.Ba2+、Mg2+、CO32-、C1- |
| C.N03-、Na+、K+、CO32- |
| D.N03-、K+、CO32-,OH- |
下列实验问题的处理方法中,正确的是
| A.用铂丝做焰色反应实验,每次做完后都需要用盐酸洗涤,再用自来水洗净后使用 |
| B.在气体发生装置上直接点燃H2气体前,必须先检验氢气的纯度 |
| C.实验结束后,应及时将废液倒人下水道,清洗仪器并摆放整齐 |
| D.在制取NH3的实验中,将多余的NH3直接用玻璃导管导入水中(注:NH3极易溶于水),以 |
免污染空气
深秋及寒冬的清晨,常出现有雾的天气,雾中小液滴直径范围是
| A.小于1 nm | B.在1~100 nm之间 |
| C.大于100 nm | D.无法确定 |
将 0.1 L 含有 0.02mol CuSO4和 0.01molNaCl 的水溶液用惰性电极电解。电解一段时间后,一个电极上得到 0.01 mol Cu,另一电极析出的气体()
| A.只有Cl2 | B.既有Cl2又有O2 | C.只有O2 | D.只有H2 |
已知热化学方程式:2SO2(g)+O2(g) 2SO3(g); H=-Q kJ·mol-1(Q>0)。下列说法 正确的是( )
2SO3(g); H=-Q kJ·mol-1(Q>0)。下列说法 正确的是( )
| A.相同条件下,2 mol SO2(g)和 1 mol O2(g)所具有的能量小于 2 mol SO3(g)所具有的能量 |
| B.将 2 mol SO2(g)和 1 mol O2(g)置于一密闭容器中充分反应后,放出热量为 Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.如将一定量 SO2(g)和 O2(g)置于某密闭容器中充分反应放热 Q kJ,则此过程中有 2 mol SO2(g)被氧化 |
下列各组实验中溶液最先变浑浊的是()
| A.0.1mol/LNa2S2O3和 H2SO4 各 5mL,加水 5mL,反应温度10℃ |
| B.0.1mol/LNa2S2O3 和 H2SO4各 5mL,加水 10mL,反应温度 10℃ |
| C.0.1mol/L Na2S2O3和H2SO4各 5mL,加水 5mL,反应温度 30℃ |
| D.0.2mol/L Na2S2O3和H2SO4各 5mL,加水 10mL,反应温度 30℃ |
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F 水溶液中含有 HF,因此 NH4F 溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成 H2 的速率 |
下列叙述正确的是
| A.将纯水加热,水的离子积变大、pH变小、溶液呈酸性 |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 |
| D.中和体积和pH都相等的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
铜锌原电池(如图)工作时,下列叙述正确的是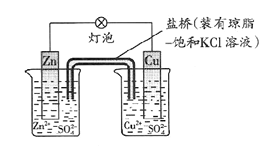
| A.一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| B.正极反应为:Zn-2e-=Zn2+ |
| C.电子从铜片经导线流向锌片 |
| D.电池工作时Zn2+和Cu2+ 的浓度保持不变 |
下列说法正确的是
| A.水解反应是吸热反应 | B.升高温度可以抑制盐类的水解 |
| C.正盐水溶液pH均为7 | D.硫酸钠水溶液pH小于7 |
下列溶液中导电性最强的是
| A.5L 0.1mol / L NH3·H2O | B.0.1L 0.2mol / L 盐酸 |
| C.5L 0.1mol / L 醋酸溶液 | D.0.1L 0.1mol / L NaOH溶液 |
下列物质不属于强电解质的是
| A.硫酸 | B.醋酸 | C.氢氧化钡 | D.硫酸钡 |
下列反应中,不能形成原电池反应的是
| A.氢氧化钠与盐酸反应 | B.金属锌与稀硫酸反应 |
| C.甲烷燃烧 | D.金属铜溶于氯化铁溶液 |