下表为元素周期表的一部分,请回答有关问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
|
① |
|
② |
|
| 3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1) ⑤ 和 ⑧ 的元素符号是_________和_________.
(2) 此表中最活泼的金属是_________,非金属性最强的元素是______(填写元素符号).
(3)在 ③ ~ ⑦ 元素中,原子半径最大的是 (填写元素符号)。
(4)表中能形成两性氢氧化物的元素是_________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:______________________;_____________________ .
氧原子的质量数为16,质子数为8,那么它的中子数是____________。
(5分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA;HA-?H++A2-回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是:——。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1 B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)==c(oH-)+c(HA-)+2c(A2-) D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能
是 0.11 mol·L-1 (填“<”,“>”,或“=”),理由是:
若有等体积的a:PH=1的盐酸,b:PH=1的硫酸,c:物质的量浓度为0.1 mol·L-1的醋酸(均用物质序号回答下列问题):
①欲均加水稀释到相同PH值,所加水的体积关系是: 。
②分别加入足量的锌粉,产生氢气体积(相同温度和压强)大小关系是
③某学生用蒸馏水润湿的PH试纸测定PH值,误差最小的是
由于空气中,按体积计算,氧气约占 ,所以硫在空气中燃烧,发出 色火焰,而在纯氧中燃烧,则发出 色火焰。生成的气体叫做 ,具有 气味。
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
1、工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
。
2、漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
3、以上涉及的物质中,属于共价化合物的有 (填两种)
属于离子化合物的有 (填两种),既有离子键又有共价键的物质有 ((填一种))
4、写出:CaCl2的电子式 H2O的结构式
氧化还原是常见的反应类型,根据信息回答以下问题: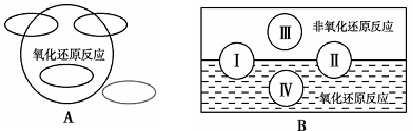
1、A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:Cl2 + 2NaBr —→ 2NaCl + Br2 所属的区域。
2、“四种基本反应类型与氧化还原反应的关系”也可用B图表达。①其中Ⅰ为化合反应,则Ⅱ为 反应。②写出一个有水生成的符合反应类型Ⅲ的化学方程式: 。③写出一个有水参加的符合反应类型Ⅳ的化学方程式 ,
其中水作为 剂。(填氧化剂、还原剂等)
3、用“单线桥”分析下列氧化还原反应的电子转移方向及数目,并填空。
(1)2HClO —光→ 2HCl + O2↑ 氧化产物 被还原的元素
(2)2NaCl + 2H2O —电解→ 2NaOH + Cl2↑ + H2↑
4、有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是 ,还原性最强的是 ,用离子方程式表示氧化性强弱的事实:
。
下图是用自来水制取少量蒸馏水的简易装置,其原理与教材中的实验完全相同。回答下列问题:
(1) 左边圆底烧瓶中要加入几片碎瓷片,其作用是 ;
(2)该装置中使用的玻璃导管较长,其作用是 ;
(3) 烧杯中还要盛有的物质是 ,其作用是: 。
Na2O2可用在潜水艇里作为氧气的一种来源,供人们呼吸所需。Na2O2所发生反应的化学方程为 。在这个反应中,电子转移的总数为 被氧化的是 价态 元素,氧化剂是 。