研究NO2、SO2 、等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3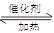 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L 。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L 。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =" -" 113.0 kJ· mol-1
2NO2(g) ΔH =" -" 113.0 kJ· mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH = kJ· mol-1。
SO3(g)+NO(g)的ΔH = kJ· mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)
氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H = KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,身被还原为四价钒化合物;四价钒化合物
再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,则由S(s)生成3 molSO3(g)的△H = 。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1) 在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。 (2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为
(写化学式)。
I. 恒温、恒压下,在一个容积可变的容器中发生如下反应: A(g)+B(g)  C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a mol C,这时A的物质的量
为_____mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为 mol。
(3)若开始时放入x mol A、2molB和l mol C,到达平衡后,A和C的物质的量分别
是y mol和3a mol,则x ="_____mol," y =_____mol。平衡时,B的物质的量_____(选
填一个编号)。
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是
________。
II. 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入l mol A和l mol B到达平衡后生成b mol C。将b与(1)小题中的a进
行比较________________ (选填一个编号)。
(甲)a < b (乙) a > b (丙) a =" b " (丁) 不能比较a和b的大小。
反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
(1)若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的
关系是 。
(2)若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_____
方向移动。
(3)如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为___态。
(4分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g乙醇燃烧生成CO2和液态水时放热29.7kJ。则表示乙
醇燃烧热的热化学方程式为_____________________________。
(2)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、
391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________
进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。
(1)25℃时,已知胃液的pH在0.9—1.5之间,请问__ 。(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由(用有关离子方程式解释)_ 。
(2)当人体中Ba2+ 浓度达到2×10-3mol·L-1时,就会对健康产生危害,若误将氯化钡当做食盐食用,请计算说明是否 可以通过服用大量5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
可以通过服用大量5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
。 (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉
(3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉 淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
① Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; ② I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子 ,现进行如下实
,现进行如下实 验:
验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶 液中肯定存在的离子是__________ _______,肯定不存在的离子是________ _____。
液中肯定存在的离子是__________ _______,肯定不存在的离子是________ _____。
(2)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl-?______________。
(3)按照反应顺序 逐步书写出②中发生反应的离子反应方程式
逐步书写出②中发生反应的离子反应方程式
① H++OH-=H2O ②_____________ _____
③________ __________ ④ HCO3-+H+=H2O+CO2↑
⑤___________ _______
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:按下图装置进行实验。并回答以下问题:
①实验前应先________________。分液漏斗中应该装___________(填“盐酸”或“稀硫酸盐”)。D装置的作用是_________________________________________;
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量固体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有______________________;
②试验中判断沉淀是否完全的方法是_______________________________________
③若加入试剂改为氢氧化钡,已知称得样品9.5g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为_________________(保留一位小数)。
草酸晶体的化学式可表示为H2C2O4·xH2O,为测定x值进行下列实验:
(1)称取W g草酸晶体,配成100.00 mL溶液。
(2)取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol·L-1KMnO4溶液滴定。KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
①实验(1)中,为配制准确的草酸溶液,必须使用的仪器有_____________________________;
②实验(2)中,滴定时,KMnO4溶液应盛在___________中(填酸式或碱式滴定管);
③若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值______(填偏高、偏低、无影响);
④滴定终点时,锥形瓶内溶液颜色变化是__________________________________;
⑤若滴定终点时,共用去KMnO4溶液V mL,求草酸溶液的物质的量浓度及x的值:
, .
A、B、C三种短周期元素在周期表中相对位置如右图:
| A |
|
|
|
| |
|
B |
C |
(1)A与C形成的液态化合物是常见的重要有机溶剂,则
A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱
的顺序是: > > (用化学式表示)。
(2)X、Y为B、C两种元素形成的单质,标准状况下,X的密度为3.17g•L-1。Z是一种化合物,焰色反应呈紫色(透过蓝色钴玻璃),室温下0.1 mol•L-1Z水溶液pH=13。X、Y、Z有如图转化关系:
①写出X与Z反应的离子方程式: 。
②已知丙能与稀硫酸反应生成能使品红褪色的气体。丁的化学式为 ,丁的水溶液pH>7的原因是: (用离子方程式表示)。
③将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4溶液(硫酸酸化)中,恰好褪色。写出反应的离子方程式 。
Ⅰ.在一个容积固定为2L的密闭容器中,发生反应:aA (g) + bB(g)  pC(g) △H=?反应情况记录如下表:
pC(g) △H=?反应情况记录如下表:
| 时间/(min) |
n(A)/( mol) |
n(B)/( mol) |
n(C)/( mol) |
| 0 |
1 |
3 |
0 |
| 第2 min |
0.8 |
2.6 |
0.4 |
| 第4 min |
0.4 |
1.8 |
1.2 |
| 第6 min |
0.4 |
1.8 |
1.2 |
| 第8 min |
0.1 |
2.0 |
1.8 |
| 第9 min |
0.05 |
1.9 |
0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率V(A)= mol•L-1• min-1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8 min时分别改变了某一个反应条件,则改变的条件分别可能是:
①第2min 或 ;
②第6min ;
③第8 min 。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92kJ则该反应的△H= 。
(4)反应在第4 min建立平衡,此温度下该反应的化学平衡常数K= .
Ⅱ.已知:常温下,A酸的溶液pH=a, B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
A.大于7 B.等于7 C. 小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为
mol•L-1,B溶液中水电离出的氢离子浓度为 mol•L-1。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为:
。
《化学反应原理》
(1)本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
(2)热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸热131.3kJ
B.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ
C.1mol碳和1mol水反应生成一氧化碳和氢气并吸热131.3kJ
D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
(3)银锌电池广泛用做各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。工作时原电池的总反应是:Ag2O+Zn+H2O===2Ag+Zn(OH)2,根据上述变化判断:
①原电池的正极是___ __。
②工作时原电池两极反应式为:
负极__________ __ ___,正极__________ ____
③工作时原电池负极附近的pH值________(填“增大”、“不变”、“减小”)
《化学与生活》
(1)化学与生活息息相关。下列叙述正确的是
A.鲜榨橙汁遇到碘水会变蓝 B.馒头越嚼越甜
C.油脂经水解可变成葡糖糖 D.土豆中的淀粉经水解可变成酒
(2)把新制的Cu(OH)2悬浊液加入到某病人的尿液中并微热,如果观察到红色沉淀,说明尿液中可能含有的物质是 ( )
A.食醋 B.白酒 C.食盐 D.葡萄糖
(3)我国农业因遭受酸雨而造成的损失每年高达15亿多元,为了有效控制酸雨,国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。
①下列措施中,你认为减少酸雨产生的途径可采用的是 。(用字母表示)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃烧脱硫煤
D.在已酸化的土壤中加石灰 E.开发新能源
②在英国进行了一个研究,结果表明:高烟囱可以有效地降低其周围地表面SO2浓度。在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱,结果使附近地面SO2浓度降低了30%之多。请你从全球环境保护的角度,分析这种方法是否可取?简述其理由。