乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下: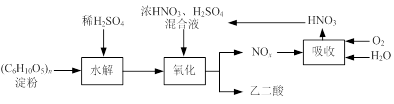
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2)氧化时控制反应液温度为55~60℃的原因是 。
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式 、 。
(2)当加入35mL盐酸时,产生CO2的体积为 mL(标准状况)。
(3)原混合物中NaOH的质量为 g,碳酸钠的质量分数为 。
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
反应①②③为_________反应(填“吸热”或“放热”)。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。
① ② ③
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=___________。该温度下平衡常数K的计算结果为____________。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是_____________
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
【改编】将等物质的量的A、B混合于1L的密闭容器中,发生反应:A(g)+ 3B(g) 2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
2C(g)+ xD(g),经2min后,测得D的浓度为0.4mol/L,c(A):c(B)=" 5:" 3,C的平均反应速率是0.1 mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值
草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为: ;
预期现象是:
①溶液的颜色由 色变为 色,
②其中加入 mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 |
A(KMnO4溶液浓度/mol·L-1) |
B(草酸溶液浓度/mol·L-1) |
C(硫酸溶液浓度/mol·L-1) |
褪色时间/s |
| 1 |
3 |
3 |
1 |
336 |
| 2 |
1 |
2 |
3 |
82 |
| 3 |
3 |
1 |
3 |
76 |
| 4 |
1 |
3 |
2 |
133 |
| 5 |
2 |
3 |
3 |
102 |
| 6 |
3 |
2 |
2 |
156 |
| 7 |
2 |
2 |
1 |
300 |
| 8 |
2 |
1 |
2 |
115 |
| 9 |
1 |
1 |
1 |
200 |
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
| |
A(KMnO4溶液) |
B(草酸溶液) |
C(硫酸溶液) |
||||||
| 浓度/mol·L-1 |
0.005 |
0.010 |
0.015 |
0.1 |
0.5 |
0.9 |
6 |
12 |
18 |
| 平均褪色时间/s |
138.3 |
172.3 |
189.3 |
130.3 |
179.3 |
190.3 |
278.7 |
134.7 |
86.7 |
(2)由表2可知,三因素中, 的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而 的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为 mol·L-1、草酸浓度为 mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
| c(H2SO4)/mol·L-1 |
18 |
16 |
14 |
12 |
10 |
8 |
6 |
| 褪色时间/s |
67 |
83 |
90 |
103 |
129 |
146 |
200 |
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为 mol·L-1和 mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
恒温下,将xmolN2与ymolH2的混合气体通入一个容积为1L的密闭容器中,发生如下反应:N2(g)+3H2(g)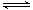 2NH3(g)。
2NH3(g)。
(1)若反应到达某时刻t时,nt(H2)=9mol,nt(NH3)=4mol,计算y的值。
(2)反应达平衡时,混合气体的体积为672L(标准状况下),其中NH3的含量(体积分数)为20%,计算平衡时NH3的物质的量及平衡常数K(保留2位有效数字)。
工业上用丁烷氧化法制醋酸,反应的化学方程式可表示为:
2C4H10+5O2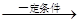 4CH3COOH+2H2O
4CH3COOH+2H2O
现用58吨丁烷为原料制取醋酸,求:
(1)理论上需要标准状况下的空气 m3(设空气中O2、N2的体积分数分别为0.2、0.8),同时生成水 吨。
(2)若生成的醋酸溶解在生成的水中,所得醋酸的质量分数为 %。
(3)若同时生产质量分数为100%的冰醋酸m1吨和质量分数为50%的醋酸m2吨,且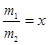 ,需补充水y吨,则y与x的关系式为 (用含x的代数式表示y);若不补充水,则m1+m2= 。
,需补充水y吨,则y与x的关系式为 (用含x的代数式表示y);若不补充水,则m1+m2= 。
碱式碳酸镁[Mgx(CO3)y(OH)z•nH2O表示]密度小,几乎不溶于水,但在水中引起轻微的碱性反应。不溶于乙醇,常温下不会分解,是橡胶制品的优良填料。工艺流程如下图:

(1)回答下列问题:
①生石灰是以石灰石与焦炭混合煅烧生成,焦炭的作用是: 。
②氢氧化镁浆液与CO2反应的化学方程式为: 。
③碱式碳酸镁用乙醇洗涤的目的是: 。
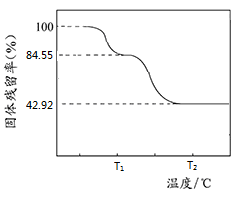
(2)某同学将4.66g碱式碳酸镁样品置于硬质玻璃管中充分灼烧至恒重,将产生的气体先通过足量的浓硫酸,再通过足量的碱石灰,碱石灰质量增重1.76g。样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图所示。根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。
氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH 3OH和H 2O在某Cu/Zn﹣Al催化剂存在下生产H 2,H 2与Mg在一定条件下制得储氢物质X。
回答问题:
(1)Al在周期表中的位置 。基态Zn的价层电子排布式 。
(2)水分子中氧原子的杂化轨道类型 。
(3)键能是衡量共价键稳定性的参数之一。 CH 3OH键参数中有 种键能数据。CH 3OH可以与水以任意比例互溶的原因是 。
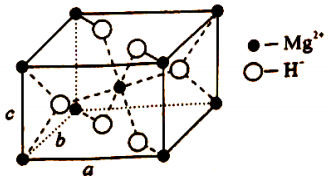
(4)X的晶胞结构如图所示(晶胞参数:α=β=γ=90°,a=b=450.25pm),密度为1.4g•cm ﹣ 3,H ﹣的配位数为 ,X的储氢质量分数是 ,c= pm (列出计算式即可)。
将6g的铁粉加入200mL Fe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL 0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
某厂每天产生800m3含氮的废水(NH3的含量为168mg∙L-1)。该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg∙L-1(假设废水处理前后体积不变)。再对加热蒸发得到的NH3进一步处理制取硝酸。
(1)制取硝酸过程中主要发生反应如下:①_________________,②4NO+3O2+2H2O=4HNO3。反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式。
(2)该厂每天通过加热蒸发可得到NH3的物质的量是__________________。
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
氢气是化工行业重要原料之一。
(1)电解饱和食盐水是生产H2的方法之一。常温下,电解250 mL饱和食盐水一段时间后,溶液质量减轻0.365 g(假设气体全部逸出)。生成的氢气在标准状况下的体积为 mL。
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1 m3 甲烷经此过程生成0.27 m3氢气,则甲烷的裂解率为 %(体积均在相同条件下测定)。
(3)已知:CxHy + H2O → CO + CO2 + H2(未配平)。工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如下表所示:
| 组分 |
CO |
CO2 |
H2 |
| 体积分数 |
20% |
5% |
75% |
计算原混合气体中甲烷与乙烷的物质的量之比。
(4)合成氨生产过程中,消耗氮氢混合气2000 m3(其中CH4的体积分数为0.112%,下同),分离液氨后的氮氢混合气中含CH4 2.8%。计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况)。
碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x H2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)MgaAlb(OH)c(CO3)d·x H2O中a、b、c、d的代数关系式为 。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO20.560L(已换算成标准状况下)。②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO32-)(写出计算过程)。

通常情况下,CO与O2的混合气体m L,用电火花引燃后体积变为n L(在相同条件下测定)。
(1)试确定原混合气体中CO与O2的体积。
(2)若反应后的气体密度在相同条件下为氢气的15倍时,试确定反应气体的组成及体积之比。
(12分)化学需氧量(COD)常作为衡量水体中有机物含量多少的指标。某化学课外小组的同学拟采用碱性高锰酸钾溶液测定某海水试样的COD,实验流程如下:
已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2
②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O
③2S2O32-+I2=2I-+S4O62-
(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是 。
(2)氧化后的水样煮沸后,需冷却并在暗处再加入KI和硫酸,需在暗处的原因是 。用Na2S2O3,标准溶液滴定,终点时溶液颜色的变化是 。
(3)滴定到终点时消耗Na2S2O3标准溶液10.00mL。根据以上实验数据计算海水试样的COD(用每升 水样相当于消耗多少毫克O2表示,单位:mg•L-1)(写出计算过程)。