[广东]2013届广东省广州市高三调研测试理综化学试卷
设nA是阿伏加德罗常数的数值。下列说法正确的是
| A.1L 0.1mol·L-1的FeCl3溶液中,Fe3+的数目为0.1nA |
| B.1molNH3中含有N-H键的数目为3nA |
| C.7.8g Na2O2中含有的阳离子数目为0.1nA |
| D.标准状况下,22.4L水中分子个数为nA |
下列说法不正确的是
| A.漂白粉长时间露置空气中会结块变质 |
| B.把NaHSO4溶液加入NaAlO2中生成白色沉淀然后沉淀又溶解 |
| C.装强碱溶液的试剂瓶需要用橡胶塞,长时间后会在瓶口有白色固体生成 |
| D.蘸有浓硫酸的玻璃棒接近浓氨水瓶口有白烟产生 |
下列离子方程式正确的是
| A.氢氧化镁与稀盐酸反应:H+ + OH-=H2O |
| B.AlCl3溶液中加入少量氨水:Al3++3OH-=Al(OH)3↓ |
| C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| D.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。其中Y所处的周期序数与族序数相等。下列说法正确的是
| |
|
X |
|
| Y |
Z |
|
W |
A.原子半径:Y<Z<W
B.气态氢化物的稳定性:X>Z
C.最高价氧化物对应水化物的酸性:Z>W
D.W的最高价氧化物与水反应形成的化合物是离子化合物
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液。当滴入NaOH溶液为20.00 mL时溶液显碱性,溶液中各离子浓度关系正确的是
| A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| C.c(Na+) + c(H+)=c(CH3COO-) + c(OH-) |
| D.c(Na+) + c(OH-)=c(CH3COO-) + c(H+) |
下列实验能达到目的的是
| A.用CCl4萃取碘水中的碘 |
| B.将足量盐酸加入混有少量CaCO3杂质的Na2SO4中可除去杂质 |
| C.将混有少量HCl的Cl2通入NaOH溶液中除去HCl |
| D.将Fe(OH)3固体加入沸水中制备Fe(OH)3胶体 |
某小组为研究电化学原理,设计如图装置,下列叙述正确的是
| A.若a和b为石墨,通电后a电极上发生的反应为2Cl--2e-=Cl2↑ |
| B.若a和b为石墨,通电后b电极上发生氧化反应 |
| C.若a为铜,b为铁,通电后a电极质量增加 |
| D.若a为铜,b为铁,通电后Cu2+向铁电极移动 |
下列实验装置图正确的是 
| A.装置①可用于做HCl喷泉实验 |
| B.装置②可用于吸收HCl气体,并防倒吸 |
| C.装置③可用于实验室制备少量NH3 |
| D.装置④b口进气可收集CO2等气体 |
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下的方案。
| 编号 |
H2C2O4溶液 |
酸性KMnO4溶液 |
温度/℃ |
||
| 浓度/ mol•L-1 |
体积/mL |
浓度/ mol•L-1 |
体积/mL |
||
| ① |
0.10 |
2.0 |
0.010 |
4.0 |
25 |
| ② |
0.20 |
2.0 |
0.010 |
4.0 |
25 |
| ③ |
0.20 |
2.0 |
0.010 |
4.0 |
50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1mol H2C2O4转移_____mol 电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4)∶c(KMnO4) ≥______________。
(2)探究温度对化学反应速率影响的实验编号是___________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是_____________。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______________ mol•L-1•min-1。
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图。
氨是最重要的化工产品之一。
(1)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如下图所示。
反应①②③为_________反应(填“吸热”或“放热”)。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为__________________。
① ② ③
(2)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
①某温度下,向容积为10L的密闭容器中通入2mol NH3和1molCO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K=___________。该温度下平衡常数K的计算结果为____________。
②为进一步提高CO2的平衡转化率,下列措施中能达到目的的是_____________
| A.提高NH3的浓度 | B.增大压强 |
| C.及时转移生成的尿素 | D.使用更高效的催化剂 |
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
已知以下四种物质的溶解度曲线图:
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为 。
| 物质 |
电离常数(25℃) |
| H2CO3 |
K1=4.4X10-7 K2=4.7X10-11 |
| H2SO3 |
K1=1.23X10-2 K2=5.6X10-8 |
大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料。 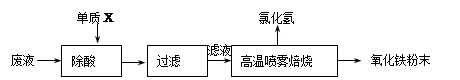
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末。有关的化学方程式为:
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种。请设计实验探究该铁红涂料中添加的物质。
①提出合理假设
假设1:添加了CuO。 假设2:添加了FeO。
②基于假设 (填“1”或“2”),设计实验方案,进行实验。在答题卡上写出实验步骤、预期现象和结论。
限选实验试剂:铁粉、3mol•L-1H2SO4、0.01 mol•L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 |
预期现象和结论 |
| 步骤1.取少量样品于试管中,_________________ ____________________________________________ |
___________________________ |
| 步骤2. ____________________________________________ |
___________________________ |
(4)用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸。请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸?(写出计算过程,结果可用数学表达式表示,不必化简)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号