将250mL2.0mol/L的硫酸与足量的铁屑充分反应。计算:
(1)生成的H2的体积(标况);
(2)将生成的FeSO4配成400mL溶液,此溶液中Fe2+的物质的量浓度
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)将2.4mol某金属投入某酸溶液中,恰好完全反应,并产生7.2g氢气,则此金属化合价为 。
(3)某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下:
| 实验次数 项目 |
第一次 |
第二次 |
第三次 |
| 所取合金的质量/g |
20 |
20 |
40 |
| 所加稀硫酸的质量/g |
100 |
120 |
80 |
| 生成氢气的质量/g |
0.4 |
0.4 |
0.4 |
①该合金中铁的质量分数是 %(结果精确到1%)。
②本实验中所加稀硫酸的溶质的质量分数为 %(结果精确到0.1%)。
天然气的主要成分为CH 4,一般还含有C 2H 6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C 2H 6(g)═C 2H 4(g)+H 2(g)△H 1,相关物质的燃烧热数据如下表所示:
| 物质 |
C 2H 6(g) |
C 2H 4(g) |
H 2(g) |
| 燃烧热△H/(kJ•mol ﹣ 1) |
﹣1560 |
﹣1411 |
﹣286 |
①△H 1= kJ•mol ﹣ 1。
②提高该反应平衡转化率的方法有 、 。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α.反应的平衡常数K p= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH 4 C 2H 6+H 2.反应在初期阶段的速率方程为:r=k×c ,其中k为反应速率常数。
①设反应开始时的反应速率为r 1,甲烷的转化率为α时的反应速率为r 2,则r 2= r 1。
②对于处于初期阶段的该反应,下列说法正确的是 。
A.增加甲烷浓度,r增大
B.增加H 2浓度,r增大
C.乙烷的生成速率逐渐增大
D.降低反应温度,k减小
(3)CH 4和CO 2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
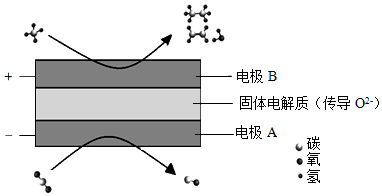
①阴极上的反应式为 。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH 4和CO 2体积比为 。
(1)3.01×1023个氯气分子的物质的量是________,氯原子的物质的量是________。
(2)1.5 mol Na2SO4·10H2O中所含的Na+的物质的量是________,所含的SO的物质的量是________,所含H2O的数目是______。
(3)一定量的Na2CO3中,碳原子和氧原子的物质的量之比为______。
(4)0.5 mol NaOH中含有电子的物质的量是__________,在________mol Na2CO3中所含Na+数目与上述0.5 mol NaOH所含Na+数目相等。
(5)12.4 g Na2R含0.4 mol Na+,则Na2R的摩尔质量为_______,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为_______。
9.2 g氮的氧化物N2Ox中含氮原子0.2 mol,则N2Ox的摩尔质量为 ;x= ,9.2 g氮的氧化物N2Ox所含的氧原子数与 g H2O所含的氧原子数相同。
把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:
(写出计算过程)
(1)原混合物中的NaOH、MgSO4、Al2(SO4)3的物质的量分别为多少?
(2)Q点HCl溶液加入量是多少mL?
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) 的熔点高于1000℃, 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 , 其晶胞结构如图所示.
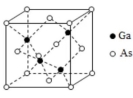
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 和 , 原子半径分别为 和 ,阿伏伽德罗常数值为 ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
0.1mol某烃的衍生物与0.35mol氧气混合密闭于一容器中,点火后发生不完全燃烧,得到CO2、CO和H2O的气态混合物。将混合气体通过浓硫酸时,浓硫酸质量增加了5.4g,通过足量澄清石灰水时,可得到沉淀20g(干燥后称量)。剩余气体与灼热的氧化铁充分反应后再通入足量澄清的石灰水中,又得到20g固体物质(干燥后)。
求:(1)该有机物的分子式。
(2)该有机物可与醇发生酯化反应,且可使溴水褪色,写出该有机物可能的结构简式和名称。
将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)按顺序写出OA 段所发生反应的离子方程式_______________________。
(2)加人35mL盐酸时,产生二氧化碳的体积为___________mL
(3)计算原混合物中Na2CO3的质量(要求写出计算过程)
计算题:将0.2molMg、Al的混合物用盐酸完全溶解,放出标准状况下5.6L气体,然后再滴入2mol/LNaOH溶液,请回答:
(1)求该混合物中Mg、Al的物质的量?(写计算过程)
(2)若该Mg、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V= ml。
(3)若该Mg、Al混合物溶于200ml 3mol/L盐酸后,滴入NaOH溶液,使所得沉淀中无Al(OH)3,则滴入NaOH溶液的体积最少为 ml。
将一定质量的镁、铝合金,投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:

(1)原合金中镁的质量为 ;
(2)盐酸的物质的量浓度为 。
(1)在标准状况下4.48L CH4和CO2混合气体的质量为6.0g,则混合气体平均摩尔质量为 g/mol,相对于氢气的密度为 ;CH4和CO2的质量比为 .
(2)相同体积、相同物质的量浓度的AgNO3溶液,分别与相同体积的KCl、CuCl2、AlCl3溶液反应恰好完全反应,则KCl、CuCl2、AlCl3三种溶液的物质的量浓度之比为 。
(3)标准状况下,V L的某气体(摩尔质量为M g•mol﹣1)溶解在1L水(水的密度近似为1g•cm﹣3)中,假设气体完全溶解且不与水发生反应,溶液的密度为ρg•cm﹣3,则所得溶液的物质的量浓度c= mol/L.(选择以上字母表达计算式,要求化简).