有镁铝合金10.2 g,将它溶于500 mL 4 mol·L-1的盐酸里,若要使沉淀质量达到最大值,则需加入2 mol·L-1氢氧化钠溶液的体积为多少?
在0 ℃、101 kPa时进行下列实验:甲、乙、丙各取30.0 mL同浓度的盐酸,加入同一镁铝合金粉末产生气体,有关数据列表如下:
| 实验序号 |
甲 |
乙 |
丙 |
| 合金质量/mg |
510 |
765 |
918 |
| 气体体积/mL |
560 |
672 |
672 |
(1)盐酸的物质的量浓度为____________。
(2)合金中镁的质量分数为____________,铝的质量分数为____________。
将等物质的量的两种氧化物溶于100 mL硫酸,而后逐滴加入1.00 mol·L-1的NaOH溶液。当加入的NaOH的体积V1="50" mL时,开始有沉淀析出,且沉淀量随NaOH加入量逐渐增加;当NaOH的体积V2="650" mL 时,沉淀量达最大值,继续滴加NaOH时,沉淀量逐渐减小;当V3≥750 mL时,沉淀量不再改变。
(1)最初加入的50 mL NaOH溶液的作用是什么?
答:__________________________________________。
(2)画出沉淀量(m)随NaOH溶液体积滴入量的变化关系,并计算所用硫酸的浓度。
图4-5
(3)试判断两种氧化物各是什么,并计算其物质的量。
将一定质量的MgAl合金投入100 mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5 mol·L-1 NaOH溶液至过量,生成的沉淀质量与加入的NaOH溶液的体积关系如图4-7所示。
图4-7
求:(1)原合金中Mg、Al质量各多少克。
(2)HCl物质的量浓度。
由铝和某种金属组成的混合物,将它分成质量相等的两份。一份放入过量的盐酸中,混合物全部作用完,放出H2 6.16 L(标准状况),溶液质量比反应前增加4.85 g;另一份放入过量烧碱溶液中,反应完毕后,放出H2 4.48 L(标准状况),溶液的质量比反应前增加3.2 g,而某金属则不反应,沉积出来。求:(1)原混合物中某金属的质量。
(2)某金属的相对原子质量。
在密闭容器中充入PCl5(g) PCl3(g)+Cl2(g),反应一段时间后又向体系中加入37Cl2含量较多的氯气,问在没有达平衡之前PCl3(g)中37Cl的含量是否会增加?为什么?
PCl3(g)+Cl2(g),反应一段时间后又向体系中加入37Cl2含量较多的氯气,问在没有达平衡之前PCl3(g)中37Cl的含量是否会增加?为什么?
某温度下在密闭容器中发生如下反应:
2M(g)+N(g) 2E(g)
2E(g)
开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%。若开始时只充入2 mol M和1 mol N的混合气体,达平衡时M的转化率为多少?
在标准状况下,1 mol A气体发生如下反应:
2A(g) B(g)+xC(g)
B(g)+xC(g)
达到平衡时,在混合气中A的体积分数为58.6%,混合气的总质量为46 g,密度为1.772 g·L-1。试计算:
(1)达平衡后,混合气的平均相对分子质量__________。
(2)达平衡后,A的转化率_________________。
(3)C气体的化学计量数x的数值__________________。
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g) 2H2(g)+O2 (g)
2H2(g)+O2 (g)
2CO(g)+O2 (g) 2CO2 (g)
2CO2 (g)
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是_______和_______,或_______和_______。
(2)若平衡时O2和CO2的物质的量分别为n(H2O)="_________" mol(用含a、b的代数式表示)。
在一定条件下可发生反应:2SO2(g)+O2 (g) 2SO3(g)。现取3 L SO2和6 L O2混合,当反应达到平衡后,测得混合气体的体积减小10%。
2SO3(g)。现取3 L SO2和6 L O2混合,当反应达到平衡后,测得混合气体的体积减小10%。
求:(1)SO2的转化率。
(2)平衡混合气体中SO3的体积分数。
在150 ℃时,1 L NO2按下式发生分解反应:2NO2 2NO+O2,当反应达到平衡状态时体积为1.2 L。求该温度下NO2的分解率。
2NO+O2,当反应达到平衡状态时体积为1.2 L。求该温度下NO2的分解率。
如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓缓通入CO2气体。恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时,容器体积缩小至最小,为原体积的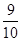 。随着CO2的继续通入,活塞又逐渐向右移动。
。随着CO2的继续通入,活塞又逐渐向右移动。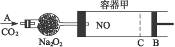
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。此时,通入标准状况下的CO2气体多少升?容器甲中NO2转化为N2O4的转化率是多少?
②活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至B处,则a值必小于0.01。其理由是_________________________________________________________________________。
(2)若改变干燥管中Na2O2的量,可通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动。则Na2O2的质量最小值应大于______________g。