某温度下,纯水中c(H+)=1.0×10-6 mol·L-1,则此时c(OH-)= ▲ mol·L-1。
在此温度下,将100 mL pH=1的稀硫酸和盐酸的混合液与100 mL未知浓度的Ba (OH)2溶液相混合,充分反应后过滤,得0.233g沉淀,滤液的pH值变为11(设混合液体积为两者之和,所得固体体积忽略不计)。
则原混合酸液中SO42-的物质的量= ▲ mol。
Cl-的物质的量= ▲ mol。
Ba(OH)2的物质的量浓度= ▲ mol·L-1 。
(1).中和pH=3的醋酸(Ka=1.75×10-5)100mL,需要 0.1mol/LNaOH溶液的体积为:____________.
0.1mol/LNaOH溶液的体积为:____________.
(2).在一定体积0.005mol/LBa(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH = 11.假设反应后溶液的体积等于Ba(OH )2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是______________.
)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是______________.
含有1mol HNO3的稀硝酸溶液与铁粉反应,所得氧化产物a、b的物质的量与加入铁粉物质的量关系如图所示(其中p、q、r为氧化产物的物质的量,n1、 n2、n3为加入铁粉的物质的量)。请回答以下问题:
(1)氧化产物a是________ b是_______
(2)P=___________________
(3)n1="________ " n2=_________
写出(2)、(3)计算过程:
将Fe2O3溶于150mL稀H2SO4中,待Fe2O3完全溶解后,加入铁粉,产生气体3.36L(标准状况),溶液中不再有Fe和Fe3+。已知加入的铁粉和氧化铁共19.2g,计算:
(1)Fe2O3的质量为 g ;
(2)稀H2SO4物质的量浓度为 。
( 6分)标准状况下,0.1mol某烃完全燃烧燃烧后,产生17.92升二氧化碳气体和9克水。该烃不能与溴水反应,但可使酸性高锰酸钾溶液褪色,则:
(1)此烃的分子式为 。
(2)该烃硝化时,一硝基取代物仅一种,则该烃的结构简式为 。
(3)该烃硝化时,一硝基取代物有3种,则该烃的结构简式为 。
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是 ;
(2)X与金属钠反应放出氢气,反应的化学方程式是 (有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y, Y在适当的条件下,可进一步被氧化生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184gX和120gZ反应能生成106gW,计算该反应的产率。(产率为实际产量与理论产量的比值)(要求写出计算过程)
(1)已知某反应的各物质浓度数据如下: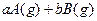

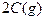
起始浓度(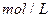 ): 1.5 1.0 0
): 1.5 1.0 0
2s末浓度(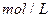 ): 0.9 0.8 0.4
): 0.9 0.8 0.4
则①a= ,b= 。
②2S内B的反应速率= 。
在100mL稀硫酸和稀盐酸的混合溶液中加入3.42g氢氧化钡固体,充分反应后(若溶液体积不变),过滤、干燥得沉淀2.33g,经测定滤液pH=13。试求原混合溶液中硫酸和盐酸的物质的量浓度分别是多少?
稀硝酸和铜反应的化学方程式如下:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,如果有3.2克铜和硝酸恰好完全反应,试计算:
(1)在标准状况下产生气体的体积是________L。
(2)将所得溶液加水配成200mL溶液,则溶液的物质的量浓度是________(保留2位有效数字)。
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体 (填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿) 。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s) ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s) ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
现有H2SO4和Na2SO4的混合溶液200mL,其中H2SO4的浓度为1 mol•L-1,Na2SO4的浓度为0.5 mol•L-1。若使该混合溶液中H2SO4和 Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
(7分)某仅由C、H、O三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在O2中完全燃烧,将产物先后通过浓H2SO4和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
把2.5 mol A和2.5 mol B混合盛入2 L容积的密闭容器里发生反应3A(g)+B(g) x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D。试求:
x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D。试求:
(1)试算x的值;
(2)达平衡时B的转化率;
(3)若达平衡时,该反应放出Q kJ的热量,写出该反应的热化学方程式;
(4)若温度和压强维持不变,达平衡时容器内气体的体积是多少?
我们可以通过以下实验步骤来验证醋酸银(CH3COOAg)的溶度积KSP=2.0×10-3:将已知质量的铜片加入到CH3COOAg饱和溶液中(此饱和溶液中没有CH3COOAg固体),待充分反应之后,将铜片冲洗 干净、干燥、称重.
干净、干燥、称重.
(1)写出表示CH3COOAg沉淀溶解平衡的方程式.
(2)刚开始铜片的质量为23.4 g,将铜片放在100 mL的CH3COOAg饱和溶液中,通过 计算说明当充分反应
计算说明当充分反应 后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(
后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(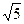 =2.24,
=2.24,  =1.41)
=1.41)