(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为mol/L。
(2)4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
将0.23 g金属钠投入到100 ml水中,使其充分反应,假设反应后溶液的体积不变。试计算:
(1)反应后所得溶液溶质的物质的量浓度是多少?
(2)产生标准状况下的气体多少毫升?
用a g氢气与b g氯气合成氯化氢气体,然后将反应后的气体用足量的氢氧化钠溶液充分吸收,试根据氢气、氯气体积比的不同情况讨论:
(1)吸收后剩余气体的质量。(2)吸收后生成食盐的质量。
将11.26克小苏打和纯碱晶体(Na2CO3• 10H2O)的混合物加热充分反应后,残留固体溶于水,配制成100克溶液,所得溶液中Na2 CO3的质量分数为6.36%,试求:
CO3的质量分数为6.36%,试求:
(1)原混合物中含小苏打及纯碱晶体的质量各是多少?
(2)若加热原混合物将失重多少克?
用KMnO4氧化密度为1.19g/cm3,溶质质量为36.5%的 HCl.反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑+ 8H2O
(1)15.8g KMnO4能使多少克HCl发生上述反应?有多少克HCl被氧化?
(2)若Cl 2在标准状况下的密度为3.17g/L,则产生的Cl 2在标准状况下的体积为多少?
(每空2分共8分)在由铜锌组成的原电池(电解质是稀硫酸)中,有位同学在铜电极收集到了12 g的气体,(1) 铜锌原电池的正、负极的电极反应:
正极:_______________________________负极:____________________________
(2) 铜电极产生12 g气体的过程中有___ __g的锌溶解。
(3) 铜电极产生12 g气体的过程中有___ __mol的电子发生了转移。
将一定质量的镁、铝合金,投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加5 mol/L NaOH溶液,生成的沉淀质量与加入NaOH溶液体积如图所示,由图中数据分析计算:

①原合金中镁的质量为______________g
②铝的质量为___________________g
③盐酸的物质的量浓度为_____________mol/L
(4分)已知SO2、SO3的混合气体质量共20.8 g,标准状况下体积为6.72 L,试求混合气体中SO2、SO3的质量及标准状况下的体积。
NaOH、MgCl2、AlCl3的混合物溶于H2O后,加入0.5mol/L的稀盐酸溶液,变化如图,求:
(1)混合物中NaOH的质量是g。
(2)P点所表示盐酸加入体积为mL。
稀硝酸和铜反应的化学方程式如下:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,如果有3.2克铜和硝酸恰好完全反应,试计算:
(1)在标准状况下产生气体的体积是________L。
(2)将所得溶液加水配成200mL溶液,则溶液的物质的量浓度是________(保留2位有效数字)。
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体(填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿)。
(2)已知:①4Fe(s) + 3O2=2Fe2O3(s) ΔH1
②4Fe3O4(s)+O2(g)=6Fe2O3(s)ΔH2
③3Fe(s)+2O2(g)=Fe3O4(s)ΔH3
则ΔH2= (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10-5。计算该温度下0.100mol/L的HX溶液的 H+浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。)
现有H2SO4和Na2SO4的混合溶液200mL,其中H2SO4的浓度为1 mol•L-1,Na2SO4的浓度为0.5 mol•L-1。若使该混合溶液中H2SO4和 Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
(7分)某仅由C、H、O三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在O2中完全燃烧,将产物先后通过浓H2SO4和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
把2.5 mol A和2.5 mol B混合盛入2 L容积的密闭容器里发生反应3A(g)+B(g) x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D。试求:
x C(g)+ 2D(g),经5s后反应达平衡。在此5s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D。试求:
(1)试算x的值;
(2)达平衡时B的转化率;
(3)若达平衡时,该反应放出Q kJ的热量,写出该反应的热化学方程式;
(4)若温度和压强维持不变,达平衡时容器内气体的体积是多少?
我们可以通过以下实验步骤来验证醋酸银(CH3COOAg)的溶度积KSP=2.0×10-3:将已知质量的铜片加入到CH3COOAg饱和溶液中(此饱和溶液中没有CH3COOAg固体),待充分反应之后,将铜片冲洗 干净、干燥、称重.
干净、干燥、称重.
(1)写出表示CH3COOAg沉淀溶解平衡的方程式.
(2)刚开始铜片的质量为23.4 g,将铜片放在100 mL的CH3COOAg饱和溶液中,通过 计算说明当充分反应
计算说明当充分反应 后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(
后铜片的质量为何值时,CH3COOAg的KSP=2.0×10-3可以得到证实.(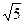 =2.24,
=2.24,  =1.41)
=1.41)