根据下列三个方程式:I2+SO2+2H2O=H2SO4+2HI; 2FeCl2+Cl2=2FeCl3;
2FeCl3+2HI=2FeCl2+2HCl+I2 有关微粒的还原性强弱顺序是
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2> I- | C.Fe2+>I->SO2>Cl- | D.SO2>I->Fe2+>Cl- |
36.5 gHCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数,则下列叙述正确的是
| A.所得溶液的质量分数:w=36.5c/1000 |
| B.36.5 gHCl气体在标准状况下占有的体积约为22.4L |
| C.所得溶液的物质的量浓度:c="1" mol·L-1 |
| D.所得溶液中含有NA个HCl分子 |
在同一容器内有X、Y、Z、Q四种物质,在合适的条件下反应,反应前后各物质的质量如下表,该反应一定属于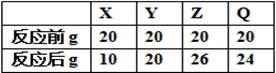
| A.氧化还原反应 | B.分解反应 | C.离子反应 | D.复分解反应 |
下列说法不正确的是
| A.过滤是根据物质颗粒大小的差别来分离或提纯物质的一种方法 |
| B.利用蒸馏可除去液态混合物中沸点不同的易挥发、难挥发或不挥发的杂质 |
| C.用四氯化碳萃取碘水中的碘,充分静置后紫红色液体在上层 |
| D.不慎将油汤洒在衣服上可用酒精 、汽油除去 |
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是
A.Na和O2 B.Ca(OH)2溶液和CO2 C.Zn和稀硫酸 D.木炭(C)和O2
离子检验的常用方法有三种:
| 检验方法 |
沉淀法 |
显色法 |
气体法 |
| 判断的依据 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应中有气体产生 |
下列离子检验的方法中不合理的是
A.CO32-——气体法 B.SO42-——沉淀法
C.H+——显色法 D.Cl-——气体法
下列物质转化需要加入氧化剂才能实现的是
| A.SO2―→SO32- | B.Cl2 ―→HCl |
| C.Na+―→Na | D.S―→SO2 |
分类方法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是
①根据碳酸钠水溶液呈碱性,则碳酸钠既属于盐,又属于碱
②根据化合物水溶液能否导电将化合物分为电解质和非电解质
③根据分散系中的分散质粒子大小将分散系分为溶液、胶体和浊液
④根据反应过程中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
| A.①③ | B.②④ | C.①④ | D.③④ |
下列离子检验的方法正确的是
| A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有Cl﹣ |
| B.某溶液中加BaCl2溶液生成白色沉淀,说明原溶液中有SO42﹣ |
| C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
| D.某溶液中加稀硫酸溶液生成无色气体,说明原溶液中有CO32﹣ |
下列说法正确的是
| A.向NaOH溶液中慢慢滴加FeCl3饱和溶液,可制得Fe(OH)3胶体 |
| B.胶体与其他分散系的本质区别是胶体能发生丁达尔效应 |
| C.除去Fe(OH)3胶体中的Na+和Cl﹣可用过滤的方法 |
| D.Fe(OH)3胶体中逐滴加入稀硫酸,会产生沉淀而后沉淀溶解 |
下列离子方程式正确的是
| A.铁和稀盐酸反应:2Fe + 6H+ = 2Fe3++3H2↑ |
| B.碳酸钠与盐酸反应:CO32-+2H+ = CO2↑+H2O |
| C.氢氧化钡与稀盐酸的反应:Ba(OH)2+2H+ = Ba2++2H2O |
| D.铜片插入硝酸银溶液中:Cu+Ag+ = Cu2++Ag |
下列说法正确的是
| A.1 mol氢约含有6.02×1023个微粒 |
| B.H2的摩尔质量是2 g |
| C.1 mol O2的质量是32 g,含有的氧原子数为2NA |
| D.2NA个H2SO4分子的摩尔质量为196 g/mol |
使用胆矾配制1 L 0.1 mol/L的硫酸铜溶液,正确的操作是
| A.将胆矾加热除去结晶水后,称取16 g溶解在1 L水里 |
| B.称取胆矾25 g,溶解在1 L水里 |
| C.将25 g胆矾溶于水,然后将此溶液稀释至1 L |
| D.将16 g胆矾溶于水,然后将此溶液稀释至1 L |
使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②用滴定管量取液体时,开始时平视读数,结束时俯视读数 ③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ④转移溶液前容量瓶内有少量蒸馏水 ⑤定容时,仰视容量瓶的刻度线 ⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.①③⑤⑥ | B.①②⑤⑥ | C.②③④⑥ | D.③④⑤⑥ |