铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加时,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为
| A.22.2% | B.75.7% | C.30.0% | D.80.6% |
印刷铜制线路板的“腐蚀液”为FeCl3溶液。已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3 =2FeCl2+CuCl2,Fe+2FeCl3 =3FeCl2,现将一铜、铁混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是
| A.溶液中一定含FeCl2,固体一定含铜 |
| B.溶液中一定含FeCl2,固体一定是铁和铜 |
| C.溶液中一定含FeCl2、CuCl2,固体一定含铜 |
| D.溶液中一定含FeCl3,固体一定是铁和铜 |
一份质量为2g的合金,与足量的盐酸完全反应生成0.1 g H2,则该合金可能是
| A.Fe-Zn合金 | B.Fe-Cu合金 |
| C.Fe-Mg合金 | D.Mg- Al合金 |
若在加入铝粉能放出H2的溶液中分别加入下列各组离子,肯定不能大量共存的是
| A.Fe3+、SO42-、C1-、Na+ |
| B.Ba2+、Mg2+、CO32-、C1- |
| C.N03-、Na+、K+、CO32- |
| D.N03-、K+、CO32-,OH- |
向KAl(S04)2溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀,反应后铝元素的主
要存在形式是
| A.Al3+ | B.Al(OH)3 |
| C.Al02- | D.Al3+和Al(OH)3 |
下列离子方程式书写正确的是
| A.向氯化铝溶液中加入过量氨水:Al3++40H- =Al02-+2H20 |
| B.NaHCO3溶液与稀硝酸反应:HC03-+H+- =C02+H20 |
| C.铁与FeCl3溶液反应:Fe+Fe3+ =2Fe2+ |
| D.FeCl2溶液与Cl2反应:Fe2+Cl2 =Fe3++2C1- |
对于反应:H-+NH3=H2+NH2-,下列说法正确的是
| A.属于置换反应 |
| B.H既是氧化剂又是还原剂 |
| C.NH2-是还原产物 |
| D.H2既是氧化产物又是还原产物 |
同温同压下,两种气体的体积相同,则两种气体
| A.所含的原子数一定相等 | B.密度一定相等 |
| C.质量一定相等 | D.所含的分子数一定相等 |
下列离子的检验方法正确的是
A.某溶液 有白色沉淀,说明原溶液中有Cl- 有白色沉淀,说明原溶液中有Cl- |
B.某溶液 有白色沉淀,说明原溶液中有SO42- 有白色沉淀,说明原溶液中有SO42- |
C.某溶液 无明显变化 无明显变化 溶液变红色,说明原溶液中有Fe2+ 溶液变红色,说明原溶液中有Fe2+ |
D.某溶液 生成无色无味气体,说明原溶液中有CO32- 生成无色无味气体,说明原溶液中有CO32- |
用NA表示阿伏加德罗常数,下列有关说法正确的是
| A.在常温常压下,11.2LN2含有的分子数小于0.5NA |
| B.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| C.将1 L2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA |
| D.46g NO2和N2O4混合气体所含氧原子数有可能为3NA |
某同学在奥运五连环中填人了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型有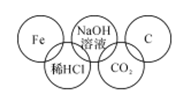
| A.复分解反应 |
| B.分解反应 |
| C.化合反应 |
| D.置换反应 |
下列实验问题的处理方法中,正确的是
| A.用铂丝做焰色反应实验,每次做完后都需要用盐酸洗涤,再用自来水洗净后使用 |
| B.在气体发生装置上直接点燃H2气体前,必须先检验氢气的纯度 |
| C.实验结束后,应及时将废液倒人下水道,清洗仪器并摆放整齐 |
| D.在制取NH3的实验中,将多余的NH3直接用玻璃导管导入水中(注:NH3极易溶于水),以 |
免污染空气
下列物理量与所对应的单位不正确的是
| A.n:mol | B.M:g.mol-1 | C.Vm,:L.mol-l | D.NA:个 |
深秋及寒冬的清晨,常出现有雾的天气,雾中小液滴直径范围是
| A.小于1 nm | B.在1~100 nm之间 |
| C.大于100 nm | D.无法确定 |