X、Y、Z、R、W是原子序数依次增大的短周期主族元素,X是元素周期表中原子半径最小的元素。X与Z同主族,Y与W同主族,R最外层电子数是电子层数的2倍。下列叙述正确的是
| A.原子半径:W>R>Z |
| B.W的最高价氧化物对应的水化物酸性比R的强 |
| C.W与X形成的是离子化合物 |
| D.W的气态氢化物的热稳定性比Y的强 |
2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标况),则反应消耗HNO3物质的量为
| A.0.05 mol | B.1mol | C.0.13mol | D.1.05mol |
有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随加入氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量之比为
| A.2∶1 | B.4∶1 | C.1∶1 | D.1∶2 |
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
| |
现象 |
解释 |
| A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
| B |
SO2能使酸性高锰酸钾溶液褪色 |
SO2具有还原性 |
| C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| D |
铁与稀硝酸反应有气泡产生 |
铁与稀硝酸发生了置换反应 |
香兰素是重要的香料之一,它可由丁香油酚经多步反应合成。
有关上述两种化合物的说法不正确的是
| A.在丁香油酚分子中至少有12个原子共平面 |
| B.1moI香兰素最多能与3mol氢气发生加成反应 |
| C.常温下,1mol丁香油酚可与2molBr2反应 |
| D.可用酸性KMnO4溶液检验丁香油酚中是否含有碳碳双键 |
已知反应2NO2(g)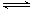 N2O4(g) △H<0,在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
N2O4(g) △H<0,在100℃时,将0.400mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
|
|
0.08 |
0.08 |
下列分析合理的是( )
A.从反应开始直至60s和80s时,二氧化氮的平均反应速率是相等的
B.80s后将容器的体积缩小为1L,平衡向正反应方向移动,气体颜色变浅
C.n1的范围是0.28<n1<0.33
D.升高温度,既能加快反应速率,也能提高N2O4的体积分数
已知碳酸氢钾溶液显碱性,25℃时向10mL0.01mol/LKHCO3溶液中滴加0.01mol/LKOH溶液,随着KOH溶液体积的增加,溶液中微粒浓度关系正确的是( )
| A.V(KOH)=0时,溶液中c(K+)=c(HCO3-)+c(H2CO3) |
| B.V(KOH)=10mL时,溶液中c(HCO3-)>c(H2CO3) |
| C.V(KOH)=20mL时,溶液中c(K+)>c(CO32-)>c(OH-)>c(H+) |
| D.对V(KOH)=10mL时的溶液升温,溶液中:c(K+)>c(OH-)>c(CO32-)>c(H+) |
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是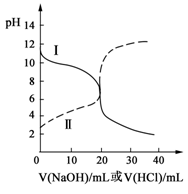
| A.曲线Ⅰ:滴加溶液到10 mL时: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| C.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=c(H+)-c(OH-) |
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。根据图示判断下列说法正确的是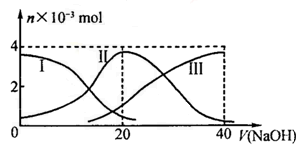
| A.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| B.向Na2A溶液加入水的过程中,pH可能增大也可能减小 |
| C.欲使NaHA溶液呈中性,可以向其中加入酸 |
| D.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)  xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
xC(g),有图I(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,试判断对图II的说法中正确的是
| A.若P3>P4,则y轴表示B的百分含量 |
| B.若P3>P4,则y轴表示混合气体的平均摩尔质量 |
| C.若P3<P4,则y轴表示B的体积分数 |
| D.若P3<P4,则y轴表示混合气体的密度 |
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )

| A.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| B.电池放电时Na+从b极区移向a极区 |
| C.每消耗3mol H2O2,转移的电子为3mol |
| D.该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
下列离子方程式正确的是
| A.向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-=I2+4Br-+2Fe3+ |
| B.向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg=4Cu+2Ag+5Mg2+ |
| C.氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
| D.向0.3mol/LNaClO溶液中滴加等体积的0.2mol/LNaHSO3溶液: |
2HSO3-+4ClO-=2SO42-+2Cl-+2HClO
25℃时,已知:Ksp[MgF2]=7.42×10-11,Ksp[Mg(OH)2]=5.61×10-12。则该温度下,下列说法正确的是( )
| A.饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/LNH4Cl溶液中的Ksp小 |
| D.在Mg(OH)2悬浊液中加入饱和NaF溶液后,Mg(OH)2不可能转化为MgF2 |
常温下,下列各溶液中,可能大量共存的离子组是
| A.pH=0的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.c(H+)=1×10-14mol•L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
| C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3- |
| D.由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、[Al(OH)4]-、S2-、CO32- |
下列各离子浓度的大小比较,正确的是( )
| A.0.2mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B.0.01mol/L的NH4Cl溶液与0.05mol/L NaOH溶液等体积混合显碱性:c(Cl-)> c(NH4+) > c(Na+) >c(OH-)>c(H+) |
| C.同浓度的下列溶液中:①(NH4)2SO4②NH4HCO3③NH4Cl,④NH3·H2O,c(NH4+)由大到小的顺序是:①>③>②>④ |
| D.常温时,将等体积的盐酸和氨水混合后,pH=7,则c(NH4+)>c(Cl-) |