(12分)I 选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上。
| A.萃取分液 |
| B.升华 |
| C.重结晶 |
| D.分液 |
E.蒸馏
F.过滤
G.洗气
(1) 分离饱和食盐水与沙子的混合物。
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(3) 分离水和汽油的混合物。
(4) 分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
(5) 除去混在乙烷中的乙烯。
(6) 提取碘水中的碘。
Ⅱ 下图是某烃A分子的球棍模型。回答下列问题:
(1)A的名称是________________________;
(2)A能够发生的反应类型有____________(填序号);
a.氧化反应 b.加成反应 c.消去反应
(3)A与溴的四氯化碳溶液反应的化学方程式是 。
为提纯下表所列有机物(括号内为所含的少量杂质),从(I)中选择适宜的试剂,从(II)中选择最佳提纯的方法,将序号填入表中。
(I)试剂:
a.浓硫酸
b.氢氧化钠
c.生石灰
d.碳酸钠
e.水
f.浓溴水
(II)方法:
| A.过滤 | B.分液 | C.蒸馏 | D.蒸发 |
| 要提纯的物质 (少量杂质) |
溴乙烷 (乙醇) |
乙醇 (水) |
乙酸乙酯 (乙酸) |
苯 (苯酚) |
| (1)选用试剂 |
|
|
|
|
| (2)分离方法 |
|
|
|
|
(3)在B的操作中,使用的主要玻璃仪器是____________________________。
用学过的知识回答下列问题
(1)用一种试剂将下列各组物质鉴别开.
① 和
和 :
:
② ,CCl4和乙醇:
,CCl4和乙醇:
(2)二甲苯苯环上的一溴代物有6种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别列表如下:
| 一溴代二甲苯 |
234°C |
206°C |
213.8°C |
204°C |
214.5°C |
205°C |
| 对应二甲苯 |
13°C |
-54°C |
-27°C |
-54°C |
-27°C |
-54°C |
由表内数据可以推断:
①熔点为234°C的一溴代二甲苯的结构简式为 ,
②熔点为-54°C的二甲苯的名称为 。
(3)有机物X的键线式为: ,芳香烃Y是X的同分异构体,Y能使溴水褪色。
,芳香烃Y是X的同分异构体,Y能使溴水褪色。
①Y的结构简式为: 。
②Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式_ 。
根据下列各组溶解度曲线图,判断分离提纯方法。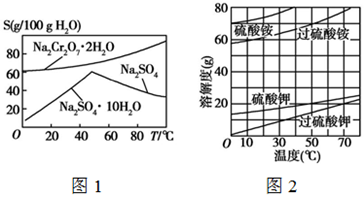
(1)根据图1中Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100 g水),由Na2SO4溶液得到Na2SO4固体的操作为:将溶液升温结晶、 、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是 。
(2)根据图2所示相关物质的溶解度曲线。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中, ,干燥。
(3)根据图1中红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。从Na2Cr2O7和 Na2SO4的混合溶液中提取红矾钠的操作为:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(选考)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n |
Ksp |
pH |
|
| 开始沉淀 |
沉淀完全 |
||
| Al(OH)3 |
1.9×10-33 |
3.43 |
4.19 |
| Fe(OH)3 |
3.8×10-38 |
2.53 |
2.94 |
| Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。.
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O,则反应③的化学方程式是 。第③步反应后,过滤沉淀时需要的玻璃仪器有 .若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式_____________________________________________。
用湿法制磷酸副产品氟硅酸(H2SiF6 )生产无水氟化氢的工艺如下图所示: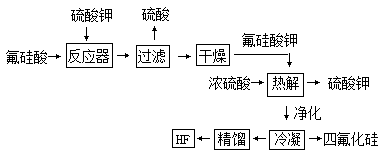
已知:氟硅酸钾(K2SiF6)微酸性,有吸湿性,微溶于水,不溶于醇。在热水中水解成氟化钾、氟化氢及硅酸。
(1)写出反应器中的化学方程式:
(2)在实验室过滤操作中所用的玻璃仪器有: ;
在洗涤氟硅酸钾(K2SiF6)时常用酒精洗涤,其目的是: ;
(3)该流程中哪些物质可以循环使用: (用化学式表达)
(4)氟化氢可以腐蚀刻画玻璃,在刻蚀玻璃过程中也会生成H2SiF6 ,试写出该反应方程式: ;
(5)为了测定无水氟化氢的纯度,取标况下的气体产物2.24L,测得质量为3.1g,并将气体通入含足量的Ca(OH)2 溶液中,得到5.85gCaF2沉淀,则无水氢氟酸质量分数为: 。(保留2位有效数字)通过计算结果,试解释,为什么标况下2.24L产物的质量远远大于2.0g, 。
【化学—选修2化学与技术】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备硫酸、聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:

请回答下列问题:
(1)过程①中,加快反应速率的方法有 。FeS和O2、H2SO4反应的化学方程式是____________。
(2)过程②中产生的气体可用于氧化产生硫酸,为使SO2尽快、尽多的转化为SO3,可采取的措施是_____(填字母)
A.高温、高压 B.适当温度、催化剂
C.通入过量的氧气 D.低温、低压
产生的尾气会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
A.浓H2SO4 B.蒸馏水 C.NaOH溶液 D.浓硝酸
(3)过程③中,需要加入的物质名称是_______。反应的离子方程式是________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用天平称取样品5.35g;②将样品溶于足量硝酸酸化后,再加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为6.99g。若该聚铁主要成分为[Fe(OH) SO4]n,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
铜工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
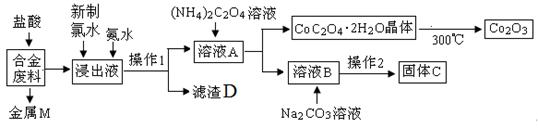
(1)金属M为 ,操作1中需要的主要玻璃仪器是玻璃棒、______、______。
(2)加入新制氯水的的作用是(用离子方程式表示) __________ 。滤渣D的主要成分是 (填化学式)。
(3)充分焙烧的化学方程式为 。如下图所示,焙烧操作中的一处错误是_________。

(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。则操作2中得到固体C的实验操作是:蒸发浓缩、 ,洗涤、干燥。90℃时Ksp(Li2CO3)的值为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
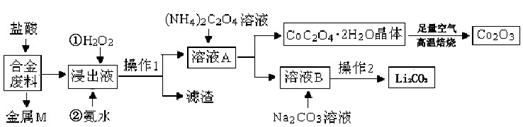
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
|
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
(1)金属M为 ,操作1为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)由CoC2O4·2H2O转化为Co2O3的化学方程式是 。
(4)知Li2CO3微溶于水,且水溶液呈碱性。其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其原因是 ,在常温条件下,饱和Li2CO3 溶液中离子浓度由大到小的排列顺序为 。
| 温度/℃ |
10 |
30 |
60 |
90 |
| 浓度/mol・L-1 |
0.21 |
0.17 |
0.14 |
0.10 |
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为 。
【改编】下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ需要的玻璃仪器有 。
(2)加入过量FeCl3溶液过程中可能涉及的离子方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得沉淀M的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则混合气体的成分是 ,标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示)。
MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下:
按要求回答下列问题
(1) 第②步操作中,氧化性强弱顺序:ClO3-______ MnO2 (填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是:__________。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是______(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。
(10 分)已知甲酸铜遇水易水解而具有还原性。实验室制备甲酸铜晶体[Cu(HCOO)2·4H2O]的流程如下: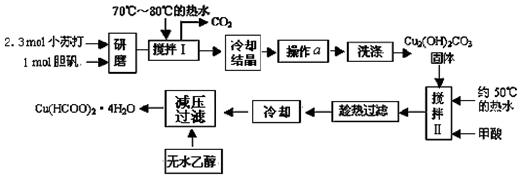
回答下列问题:
(1)研磨时应该将固体原料放在(填仪器名称) 中;制备 Cu2(OH)2CO3时需要用到70℃~80℃的热水溶解小苏打和胆矾的混合物,其目的是 。
(2)写出用小苏打、胆矾制备 Cu2(OH)2CO3的离子方程式 ;实际操作中的小苏打与胆矾 的物质的量之比大于 2∶1,原因是 。
(3)操作a 的名称是 。
(4)证明Cu2(OH)2CO3沉淀已经洗涤干净的实验方法是 。
(5)实验中用无水乙醇洗涤产物的目的是 。
某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
(1)操作①是_________;操作②是_________;操作⑤是_________。(填操作名称)
(2)操作②需要的主要玻璃仪器除烧杯外,还需要_________。
(3)加入足量的X、Y、Z是为了除去溶液中的杂质,它们依次是BaCl2溶液 、KOH溶液和 _____溶液。
(4)检验无色溶液B中是否含有SO42-的方法是_________。
由Fe2O3、CuO、C组成的混合粉末,取样品进行下列实验(部分产物略去):
(1)将Y过滤:
①滤渣中两种固体为_____________、_____________。(填元素符号)
②若向滤液中通入氯气,反应的离子方程式是_____________________________。
③若向滤液中加入NaOH溶液,搅拌,反应的方程式有两个。(是离子反应的写离子方程式)分别为:________________________、____________________;
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_______________________________________________;
②若Z为两种气体,试剂a为适量水,则Z中两种气体的化学式是________、_______。