27.下图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学想定量测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,
加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
(1)第一次读数为 mL。
(2)滴定终点的判断方法 。
(3)经过计算,此碘盐碘元素的含量为 mg·kg-1(用含a、b的最简表达式表示) 。
(4)下列操作可能会导致测量结果偏低的是 。
| A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g |
| B.步骤1所配食盐溶液未完全转移至锥形瓶 |
| C.步骤2中滴定管洗涤后未润洗 |
| D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
(5)请在答题纸的方框内画出正在排气泡的碱式滴定管(仅画出刻度以下部分)
【化学选修-化学与技术】(15分)将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要___________________等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式_________________.
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32﹣的方法是__________________.
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) |
0 |
20 |
60 |
| K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体___________g.
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是_______.
A.熔点较低(29℃熔化) b.能导电
c.能制冷 d.无毒
(7)上述工艺流程中体现绿色化学理念的是________________________________.
碱式碳酸锌【xZnCO3·yZn(OH) 2·zH2O】主要用做橡胶硫化促进剂,工业上利用锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)生产碱式碳酸锌的工艺流程如下:
请回答下列问题:
(1)向锌焙砂加入足量稀硫酸进行酸溶的过程中,所发生反应的离子方程式为 、___ _(写其中任意两个)。
(2)从滤渣I中分离出SiO2的部分流程如下: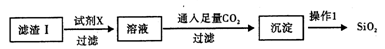
①试剂X的名称为____ 。②操作1的方法为________ 。
(3)加入锌粉的目的是____ ,从滤渣Ⅱ中获取铜的操作方法为 。
(4)高温煅烧碱式碳酸锌得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L,则该碱式碳酸锌的化学式为 。
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下: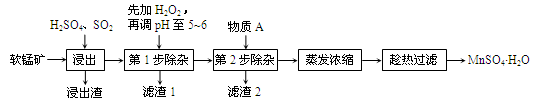
已知:Fe3+、Al3+、Mn2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、10.4、12.4;温度高于27℃时,MnSO4的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为________。
(2)“浸出”过程中Fe2O3转化为Fe3+和Fe2+,相关反应的离子方程式为________。
(3)“滤渣1”的主要成分是__________,“调pH至5~6”所加的试剂是_________(填“石灰水”或“稀硫酸”)。
(4)根据下表数据,选择“第2步除杂”所加的物质A(由一种阳离子和一种阴离子组成),物质A的化学式为________。
 阴离子 阴离子Ksp  阳离子 |
CO32- |
F- |
OH- |
| Ca2+ |
5.0×10-9 |
1.5×10-10 |
4.7×10-6 |
| Mg2+ |
3.8×10-6 |
7.4×10-11 |
5.6×10-12 |
| Mn2+ |
2.2×10-11 |
5.3×10-3 |
2.1×10-13 |
| Zn2+ |
1.2×10-10 |
3.0×10-2 |
6.9×10-17 |
(5)采用“趁热过滤”操作的原因是________。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- ,
(2)由第二份进行的实验可知混合物中应含 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是( )
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是___ 。
(2)实验室用MnO2与浓盐酸反应制取氯气的过程中,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a.KI溶液 b.FeCl2溶液 c.KCl溶液
写出你选择的一种吸收试剂与Cl2反应的离子方程式:____ 。
也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是____ 。
(3)以粗盐为原料制备亚氯酸钠(NaClO2)的工艺流程如下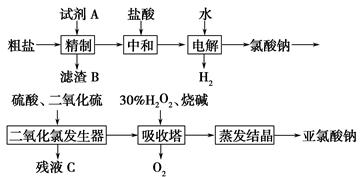
写出二氧化氯发生器中生成二氧化氯的离子方程式 。
(4)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: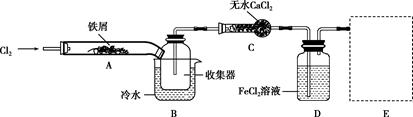
a.检验装置的气密性;
b.通入干燥的Cl2,赶尽装置中的空气;
c.用酒精灯在铁屑下方加热至反应完成;
d.在沉积的FeCl3固体下方加热
e.体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
①装置D中FeCl2的作用是 ,写出检验FeCl3的离子方程式 。
②画出尾气吸收装置E并注明试剂。
③该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,FeCl3与H2S反应的离子方程式为________________ 。
固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3,某同学设计并进行实验对该混合物进行分离,以得到纯净的AlCl3和FeCl3,图甲是该同学设计并进行的实验:
(1)操作Ⅱ中加入的试剂A,最好选用_____(填序号)。
A.酸性KMnO4溶液 B.硝酸 C.H2O2 D.浓硫酸
(2)操作V的离子方程式为_______________;操作Ⅶ的离子方程式为___________________。
(3)图乙是操作Ⅵ制取无水FeCl3和操作X制取无水AlCl3的部分装置(铁架台、加热装置等略去)。
①图乙中,装置a由____________、圆底烧瓶、双孔塞和导管组成。
②循环物质A是______________________。
③装置b中填充的物质可以是_______________________(填编号)。
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.五氧化二磷
(4)你认为该同学的实验最后_____________(填“能”或“不能”)得到纯净的AlCl3和FeCl3。若不能,请你完善该同学的实验步骤设计:________________(用文字叙述。如能,则不需回答)。
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO2和MnCO3)样品转化为纯MnO2实验,其流程如下: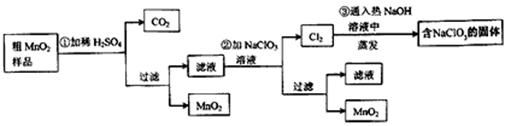
(1)第①步加稀H2SO4时,粗MnO2样品中的___________(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式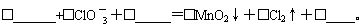
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、__________、________、________,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有_______________________(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7gMnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要______mol NaClO3。
某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 |
开始沉淀 |
完全沉淀 |
| Al(OH)3 |
3.8 |
5.2 |
| Fe(OH)3 |
2.7 |
3.2 |
| Fe(OH)2 |
7.6 |
9.7 |
| Ni(OH)2 |
7.1 |
9.2 |
回答下列问题:
(1)操作c中需使用的仪器除铁架台(带铁圈)、酒精灯、玻璃棒外还需要的主要仪器为 。
(2)“碱浸”过程中发生的离子方程式是 , 。
(3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(5)“调pH为2~3”的目的是 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。
工业上生产高氯酸(沸点:90oC)时还生产了亚氯酸钠,其工艺流程如下: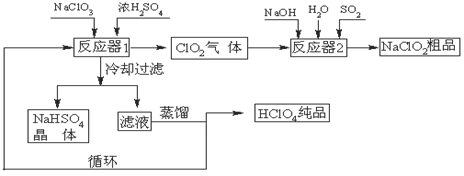
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
(共12分)某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I. 向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
II. 向I所得固体中加入过量稀H2SO4,充分反应后过滤;
III. 向II所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
IV. ……
(1)步骤I中发生反应的化学方程式为 、 。
(2)步骤II所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因 。
(3)步骤III获得CuSO4溶液的离子方程式为 。
(4)步骤II所得滤液经进一步处理可制得Na2FeO4,流程如下:
写出由Fe(OH)3制取Na2FeO4的化学方程式___________ 。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量 、
、 等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(
等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(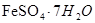 ),其过程如下:
),其过程如下: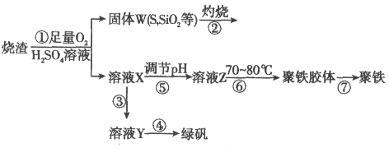
请回答下列问题:
(1)过程①中,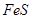 和
和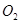 、
、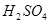 反应的化学方程式是______________。
反应的化学方程式是______________。
(2)过程②中产生的气体会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
a.浓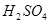 b.蒸馏水 c.
b.蒸馏水 c.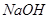 溶液 d.浓硝酸
溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是_____________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用天平称取样品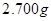 ;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为
;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为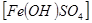
 ,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr2·2H2O的主要流程如下:
(1)与液溴的反应温度不能超过40℃的原因是 。
(2)滤渣的成分可能是 。
(3)试剂M是 ,加入M的目的是 。
(4)操作Ⅱ的步骤为蒸发浓缩、 、洗涤、干燥
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式 。
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为 。(相对原子质量:Ca—40 Br—80 H—1 O—16)
氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。工业上制备无水FeCl3的一种工艺如下:
(1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为________________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度 (g/100 g H2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是__________________________。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+ 开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1 ( 已知:Ksp[Fe(OH)3]=1.1×10-36 ) 。
(4)吸收剂X是__________________;吸收塔中吸收剂X的作用是_______________________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容; 取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol·L-1 Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL。则样品中氯化铁的质量分数为____。
实验室中,用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高纯氧化铁(a—Fe2O3)的步骤如下:
回答下列问题:
(1)上述实验中,加入铁粉的作用是____________。(用离子方程式表示)实验中检验溶液x中的离子是否与铁粉完全反应的试剂是____________溶液
(2)实验室欲用18.4 mol·L-1的浓硫酸配制100 mL5.0mol·L-1的硫酸溶液,所用仪器除胶头滴管、量筒、烧杯、玻璃棒外,还有_________(填写仪器名称);
(3)某同学用下图所示装置实现向溶液Y中通入NH3和CO2
①上述装置的中,仪器a的名称是_______;装置B的作用是____________________。
②圆底烧瓶内放置的固体药品为________(填化学式);试管内发生反应的化学方程式为__________。
③甲、乙、丙三位同学分别用上述装置进行实验,装置C的试剂瓶内溶液体积相等。
若甲、乙两同学实验中,通入的NH3和CO2的物质的量之比分别为2:l和l:l,恰好完全反应后,溶液中水的电离程度a甲________(填“>”“=”或“<”)a乙。
若丙同学未用装置D,则反应后溶液中离子浓度间的关系为[H+]+[NH4+]=_______。