某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
| |
溶液中检测出的溶质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NaCl |
| 第二次 |
KCl、BaCl2、Na2CO3、NaCl |
| 第三次 |
KCl、K2CO3、Na2SO4、NaCl |
(1)三次检测结果中,第 次的结果肯定不正确。
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
| 实验步骤 |
实验操作 |
实验目的 |
反应的离子方程式 |
| 第一步 |
向溶液中滴加过量的硝酸 |
检验 ① 的存在 |
② |
| 第二步 |
继续滴加过量的 ③ 溶液 |
检验SO42-的存在 |
④ |
| 第三步 |
过滤,再向滤液中滴加 ⑤ 溶液 |
检验 ⑥ 的存在 |
Ag++Cl- = AgCl↓ |
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由)。
由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下: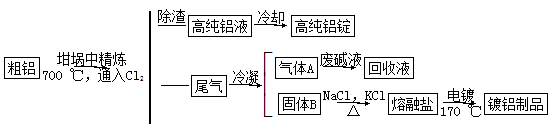
(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为:
①____________
②____________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有_________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在__________。
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为:________________。
(4)镀铝电解池中,金属铝为________极。熔融盐电镀液中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电极的主要电极反应式为___________。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是______________。
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2 (g) + O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g) ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
①V2O5的使用会使图中B点 (填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为 mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。
①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步: 。(用离子方程式表示)
②调节溶液pH为3~4的目的是 ,调节时加入的试剂可以为 。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式: 。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式: 。
以食盐为原料进行生产并综合利用的某些过程如图所示.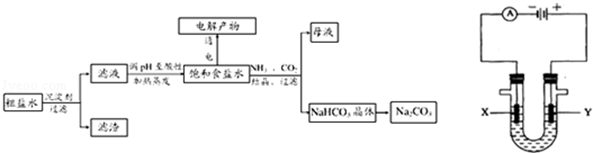
(1)除去粗盐中的Ca2+、Mg2+和SO42﹣离子,加入下列沉淀剂的顺序是(填序号) .
a.Na2CO3b.NaOHc.BaCl2
(2)将滤液的pH调至酸性除去的离子是 .
(3)如图表示电解饱和NaCl溶液的装置,X、Y是石墨棒.实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是 ,在X极附近观察到的现象是 ;Y电极上的电极反应式是 ,检验该电极反应产物的方法是 .电解NaCl溶液的离子方程式是 .
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 .
(5)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH﹣)的比值是 .
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 |
污染物 |
处理措施 |
方法类别 |
| A |
废酸 |
加生石灰中和 |
物理法 |
| B |
Cu2+等重金属离子 |
加硫酸盐沉降 |
化学法 |
| C |
含纯碱的废水 |
加石灰水反应 |
化学法 |
(2)下图是某市污水处理的工艺流程示意图:
① 下列物质中不可以作为混凝剂(沉降剂)使用的是 (填字母编号,可多选)。
A.偏铝酸钠 B.氧化铝 C.碱式氯化铝 D.氯化铁
② 混凝剂除去悬浮物质的过程是 (填字母编号)。
A.只是物理过程 B. 只是化学过程 C. 是物理和化学过程
(3)在氯氧化法处理含CN一的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。现用氯氧化法处理,发生如下反应:
KCN + 2KOH + Cl2 =" KOCN" + 2KCl + H2O 再投入过量液氯,可将氰酸盐进一步氯化为氮气。请配平下列化学方程式:口KOCN + 口KOH + 口Cl2→口CO2 + 口N2 + 口KCl + 口H2O若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
碱式碳酸锌【xZnCO3·yZn(OH) 2·zH2O】主要用做橡胶硫化促进剂,工业上利用锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)生产碱式碳酸锌的工艺流程如下:
请回答下列问题:
(1)向锌焙砂加入足量稀硫酸进行酸溶的过程中,所发生反应的离子方程式为 、___ _(写其中任意两个)。
(2)从滤渣I中分离出SiO2的部分流程如下: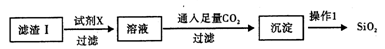
①试剂X的名称为____ 。②操作1的方法为________ 。
(3)加入锌粉的目的是____ ,从滤渣Ⅱ中获取铜的操作方法为 。
(4)高温煅烧碱式碳酸锌得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L,则该碱式碳酸锌的化学式为 。
(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下: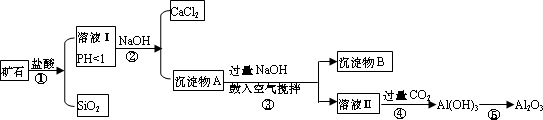
(1)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有__________________;
(2)步骤③中NaOH参加反应的离子方程式____________________________,鼓入空气并充分搅拌的目的是(用化学方程式表示)____________________;
(3)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是_____________________。
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法。
(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是_________(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为 。家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入 中可再生。
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阳极的主要电极反应式是________________。在阴极附近加入无色酚酞,看到的现象是__________________。淡水的出口为________(填“a”“b”或“c”)。

(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)_____________。
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42―。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。加热至沸的目的是___________。滤渣的主要成分是_______________、____________________。
某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32—、SO32—、SO42—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
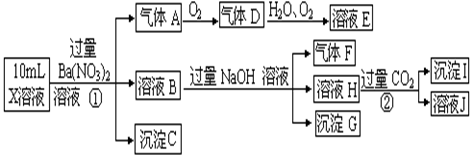
(1)上述离子中,溶液X中除H+外还一定含有的离子是 ,不能确定的阴离子是 ,若要用实验证明该离子存在,其化学方法是 ;
(2)写出下列反应的离子方程式:
①中生成气体A: ,
②生成沉淀I: 。
(3)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.06mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是_________,沉淀C物质的量___________。
某溶液仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 |
K+Ag+Mg2+Cu2+Al3+NH4+ |
| 阴离子 |
Cl-CO32- NO3- SO42-I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是________________。
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有_______,阴离子有______;并据此推测原溶液应该呈______性,原因是________________(用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为__________。充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的制备流程如下: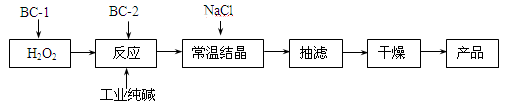
(注:BC-1、BC-2均为稳定剂,其中BC-1是由异丙醇和三乙醇胺按一定比例混合而成)
(1)结晶过程中加入氯化钠、搅拌,作用是 。
(2)加入BC-2稳定剂与工业纯碱中含有的Fe3+ 杂质生成稳定的配合物的目的是 。
(3)洗涤抽滤产品,应选用合适的洗涤试剂是 (填写序号)。
| A.饱和氯化钠溶液 | B.水 | C.异丙醇 | D.碳酸钠饱和溶液 |
(4)工业上常以活性氧的质量分数[ω(活性氧)=16 n(H2O2) / m(样品) ×100﹪]来衡量过碳酸钠产品的优劣,ω≥13﹪为优等品。现将0.2000g某厂家生产的过碳酸钠样品(所含杂质不参与后面的反应)溶于水配成溶液,加入适量稀硫酸酸化,再加入足量KI,摇匀后静置于暗处,充分反应后加入少量淀粉试剂,用0.1000mol/LNa2S2O3溶液滴定到终点,消耗Na2S2O3溶液33.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI),通过计算判断样品是否为优等品(写出计算过程)。
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。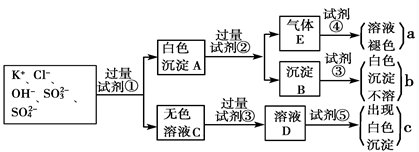
请回答下列问题:
(1)白色沉淀A与试剂②反应的离子方程式是__________________________________。
(2)无色溶液C中加入试剂③的主要目的是____________________________________。
(3)试验中若只加试剂③而不加试剂②,对实验的影响是_______________________。
(4)气体E通入试剂④发生反应的离子方程式是__________________________________。
已知在含HNO3的溶液中放入Al不生成H2;某无色溶液里,只含有下列11种离子中的几种:Mg2+、Fe3+、H+、Ag+、Ba2+、SO42-、HCO3-、OH-、MnO4-、NO3-、CO32-。已知该溶液能跟金属铝反应,且放出的气体只有氢气。试回答:
(1)若溶液跟铝反应只有AlO2-生成,则原溶液一定含有的大量的物质是________(填化学式),发生反应的离子方程式是_____________________________________________________,还可能含有的较多的物质是__________________(填化学式)。
(2)若溶液跟铝反应后有Al3+生成,则原溶液中可能(包括一定能)大量存在的离子是_____________。