下图为海水综合利用的工业流程图,判断下列说法正确的是
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
常温下,某溶液A中可能含有NH4+、Na+、Al3+、Fe2+、Fe3+、CO32-、SO32-、Cl-、SO42-,现取该溶液进行相关实验,实验结果如图所示:
下列有关说法正确的是
| A.溶液中一定有SO42-,可能有Cl- |
| B.溶液中一定不存在的只有Fe2+和CO32- 两种离子 |
| C.溶液中一定存在Al3+、Na+ |
| D.生成的甲、乙两种气体均无色,且均易溶于水 |
某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去).下列说法的是( )

| A.起始滤液常温下pH=7 | B.试剂Ⅰ为Ba(NO3)2溶液 |
| C.上图过程须经2次过滤 | D.步骤③目的是除去CO32- |
(改编)下列除杂方法正确的是
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯
| A.①②③ | B.②④⑤ | C.③④⑤ | D.②③④ |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是
| A.原溶液中c(Fe3+)=0.2 mol·L-1 |
| B.要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
| C.SO42-、NH4+、Na+一定存在,CO32-,Al3+一定不存在 |
| D.溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1 |
某溶液可能含有Na+、Ag+、Al3+、S2-、CO32-、SO42-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色为黄色.根据以上实验现象,下列关于原溶液中离子成分的推测正确的是( )
| A.一定有S2-、SO32-、Na+ | B.一定没有Ag+、Al3+ |
| C.可能只有Na+、S2-、CO32- | D.一定有Na+、S2-、NO3 |
某无色混合气体可能含有CO2、CO、H2O(g)、H2中的一种或几种,依次进行如下连续处理(每步处理均反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清的石灰水时,溶液变得浑浊.由此可以确定原混和气体中
| A.一定含有CO2、H2O,至少含有H2、CO中的一种 |
| B.一定含有H2O、CO,至少含有CO2、H2中的一种 |
| C.一定含有CO、CO2,至少含有H2O、H2中的一种 |
| D.一定含有CO、H2,至少含有H2O、CO2中的一种 |
某无色溶液,溶质仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:
⑴ 取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
⑵ 在⑴所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
⑶ 在⑵所得溶液中加入过量Ba(OH)2溶液并加热也有气体生成,同时析出白色沉淀乙。
则下列离子在原溶液中一定存在的有
| A.SO42-、AlO2─、Na+、CO32─ | B.Na+、CO32─、AlO2─ |
| C.CO32─、Na+、Al3+ | D.MnO4─、Na+、CO32─ |
下图的实验装置用来分离CO2和CO 气体并干燥。图中a 为止水夹,b 为分液漏斗的活塞,通过Y 型管和止水夹分别接c.d 两球胆,现装置内的空气已排尽。为使实验成功,甲、乙、丙分别盛放的溶液是
| A.饱和NaHCO3溶液、12mol·L-1盐酸、18.4mol·L-1H2SO4 |
| B.饱和Na2CO3溶液、2mol·L-1 H2SO4.、饱和NaOH 溶液 |
| C.饱和NaOH 溶液、2mol·L-1 H2SO4、18.4mol·L-1H2SO4 |
| D.18.4mol·L-1H2SO4、饱和NaOH 溶液、18.4mol·L-1H2SO4 |
某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100 mL的两份溶液进行如下实验。
①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是
| A.由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L |
| B.原溶液肯定没有Fe3+、Mg2+,一定含有Na+ |
| C.n(NH4+):n(Al3+):n(SO42-)=3:1:10 |
| D.原溶液一定存在Cl- |
溶液X中含有右表离子中的某5种,且其浓度均为 0.1mol/L(不考虑水的电离与离子水解)。向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是
| 阳离子 |
阴离子 |
| Na+Ca2+ Fe2+Al3+ Fe3+ Mg2+ |
OH- HCO3-CO32-Cl-NO3- SO42- |
A.X溶液中不可能含有HCO3-或CO32-
B.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+=3Fe3++NO+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
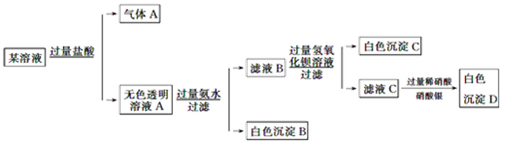
下列说法正确的是( )
| A.原溶液中一定存在AlO2-、CO32-、SO42-、Cl-四种离子 |
| B.原溶液中是否存在Na+无法判断 |
| C.原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ |
| D.生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓ |
在检验用FeCl3溶液生产铜制印刷线路板后所得的废液成分的实验中,下列根据实验现象得出的结论不正确的是
| A.向废液中加入少量的葡萄糖溶液,无红色沉淀产生,说明废液中不含Cu2+ |
| B.向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有Cl- |
| C.向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+ |
| D.向废液中滴加KSCN溶液,无现象,再加入氯水后溶呈血红色,说明废液中含有Fe2+ |
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
| A.将茶叶灼烧灰化,选用①、②和⑨ |
| B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦ |
| C.过滤得到滤液,选用④、⑤和⑦ |
| D.检验滤液中的Fe3+,选用③、⑧和⑩ |
某无色稀溶液X中,可能含有如表所列离子中的某几种。
| 阴离子 |
CO、SiO、AlO、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
下列说法正确的是( )
A.若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和NH4+
B.若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为2:1:4