雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性离子:Na+、 、Mg2+、Al3+、
、Mg2+、Al3+、 、
、 、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
、Cl-。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+8Al+5OH-+2H2O 3NH3↑+8
3NH3↑+8
根据以下的实验操作与现象,该同学得出的结论不正确的是
| A.试样中一定不含Al3+ |
B.试样中肯定存在 、Mg2+、 、Mg2+、 和 和 |
| C.试样中可能存在Na+、Cl- |
| D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4 |
某混合物的水溶液中可能含有以下离子中的若干种:Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-,现分别取100 mL的两份溶液进行如下实验。
①第一份加过量NaOH溶液后加热,收集到0.03 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,过滤后的沉淀经足量盐酸洗涤、干燥后,得到23.3g固体,向滤液中加入AgNO3溶液又有白色沉淀产生。下列有关叙述正确的是
| A.由①可知原溶液存在离子为NH4+,其浓度为0.03mol/L |
| B.原溶液肯定没有Fe3+、Mg2+,一定含有Na+ |
| C.n(NH4+):n(Al3+):n(SO42-)=3:1:10 |
| D.原溶液一定存在Cl- |
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量变为2.33g。
根据上述实验,下列推测正确的是
| A.依据电荷守恒,推测一定存在K+和NH4+ |
| B.100mL溶液中含0.01mol CO32- |
| C.Ba2+一定不存在,Mg2+可能存在 |
| D.2.33g沉淀中含BaCO3和BaSO4 |
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验:
下列说法正确的是
| A.无法确定原试液中是否含有Al3+、Cl- |
| B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ |
| C.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- |
| D.无法确定沉淀C的成分 |
某无色澄清溶液中可能含有以下离子中的若干种:Na+、Cu2+、Ba2+、Fe2+、SO42-、Cl-、Br-现取部分溶液依次进行如下实验:
①通入一定量氯气后,加入CCl4振荡,静置后CCl4层呈橙红色,用分液漏斗分液;
②向分液后的水溶液中加入足量硫酸钠溶液,产生白色沉淀;
③过滤后将滤液分为两份,向一份中加入硝酸酸化的硝酸银溶液,产生大量沉淀;根据上述实验,以下推测正确的是
| A.原溶液中肯定存在的离子有Ba2+、Br-、Fe2+ |
| B.无法确定原溶液中是否存在Cl-、Na+、SO42- |
| C.原溶液一定显中性 |
| D.原溶液中肯定不存在的离子有Ba2+、Fe2+ |
(改编)下列除杂方法正确的是
①除去乙烷中少量的乙烯:通入H2,加催化剂反应
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去NaBr溶液中的NaI:用氯水氧化NaI,再用CCl4萃取分液
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏
⑤只含有泥沙的粗盐:可通过溶解、过滤、蒸发、结晶的方法提纯
| A.①②③ | B.②④⑤ | C.③④⑤ | D.②③④ |
某溶液中可能含有H+,Na+,Ba2+,Mg2+,Fe3+,Al3+,SO42﹣,CO32﹣等离子,当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列判断正确的是
| A.原溶液中一定含有H+、Fe3+、Al3+,可能含Ba2+ |
| B.原溶液中含Fe3+和Al3+,物质的量之比为l:l |
| C.原溶液中可能含有CO32﹣ |
| D.反应最后形成的溶液中含有的溶质只有NaAlO2 |
某溶液中含有的离子可能是K+、Ba2+、A13+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:①取少量溶液加氢氧化钠溶液过程中无沉淀生成;②另取少量原溶液,逐滴加入5 mL0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是:
| A.该溶液中一定不含Ba2+ 、Mg2+、A13+、SiO32-、Cl- |
| B.该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| C.该溶液是否有K+ 需做焰色反应(透过蓝色钴玻璃片) |
| D.可能含有Cl- |
下列说法正确的是
| A.某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42- |
| B.某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32- |
| C.某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+ |
| D.某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl- |
实验是研究化学的基础,下图中所示的实验方法、装置或操作均正确的是 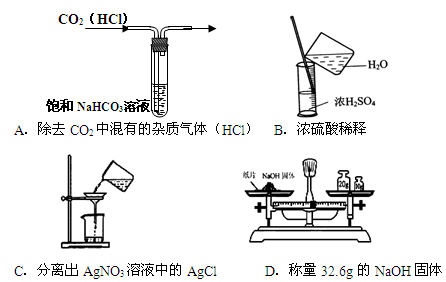
某溶液中可能含有下列6种离子中的某几种:Cl—、SO42—、CO32—、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42—、CO32—、NH4+,可能存在Cl—、Na+、K+ |
| B.一定存在Cl—、SO42—、CO32—、NH4+,一定不存在Na+、K+ |
| C.c(CO32—)=0.01mol·L-1,NH4+>SO42— |
| D.如果上述6种离子都存在,则c(Cl—)>c(SO42—) |
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必需提供下列哪项数据( )
| A.M(OH)2溶液的物质的量浓度 |
| B.与M CO3反应的盐酸的物质的量浓度 |
| C.MCO3的质量 |
| D.题给条件充足,不需要再补充数据 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验:
下列说法正确的是
| A.原溶液中c(Fe3+)=0.2 mol·L-1 |
| B.要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
| C.SO42-、NH4+、Na+一定存在,CO32-,Al3+一定不存在 |
| D.溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1 |
下列实验操作正确且能达到相应实验目的的是
| |
实验目的 |
实验操作 |
| A |
称取2.0gNaOH固体 |
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B |
制备Fe(OH)3胶体 |
向沸水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
| C |
检验溶液中是否含有SO42- |
取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
| D |
萃取碘水中的碘 |
将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
某强酸性溶液中可能存在 中的若干种,现取适量溶液进行如下实验
中的若干种,现取适量溶液进行如下实验
下列有关判断正确的是
A.原溶液中一定有.
B.原溶液中一定没有
c.步骤③中反应的离子方程式为
D.气体A、B之间肯定不能发生反应