黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应)。某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数。
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100 mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00 mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次。
已知:4FeS2+11O2 2Fe2O3+8SO2;
2Fe2O3+8SO2;
2KMnO4+5SO2+2H2O K2SO4+2MnSO4+2H2SO4
K2SO4+2MnSO4+2H2SO4
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是 。
(2)通入空气的作用是 。
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数 (填“偏高”、“偏低”或“不变”)。
(4)滴定时,应选择图中的 (填字母序号)盛装标准H2C2O4溶液,根据 现象来判断滴定已经达到终点。
(5)滴定过程中发生反应的离子方程式是 。
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是 (保留到小数点后1位)。
Ⅰ.已知:I2+2S2O=S4O+2I-。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,用淀粉溶液作指示剂,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①CuCl2溶液与KI反应的离子方程式为 。
②该试样中CuCl2·2H2O的质量百分数为 。
Ⅱ.乙醇是重要的有机化工原料,可由乙烯直接水合法生产。
已知:乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g) △H=—45.5KJ·mol-1
下图为气相直接水合法乙烯的平衡转化率与温度、压强的关系(其中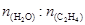 =1:1)
=1:1)
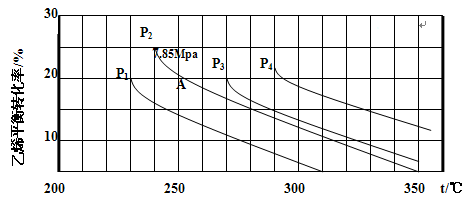
(4)图中压强(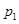 、
、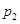 、
、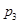 、
、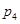 )由大到小顺序为 。
)由大到小顺序为 。
(5)计算乙烯水合制乙醇反应在图中A点(P2=7.85Mpa,乙烯平衡转化率为20%)的平衡常数Kp= (要求写出解题过程)。
本小题提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数。
钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: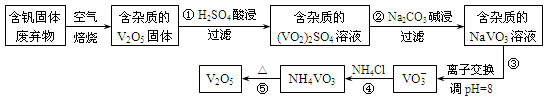
部分含钒化合物在水中的溶解性如下表:
| 物质 |
V2O5 |
NH4VO3 |
VOSO4 |
(VO2)2SO4 |
| 溶解性 |
难溶 |
难溶 |
可溶 |
易溶 |
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________。
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。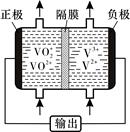
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
(NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用如图所示装置进行实验(夹持和加热装置略)

实验1:连接装置A﹣B﹣C﹣D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸 70.00mL)通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2.品红溶液不褪色。取下装置B,加入指示利.用0.2000moI/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00mL,经检验滴定后的溶液中无SO42﹣。
(1)仪器X的名称是 .
(2)滴定前,下列操作的正确顺序是 (填字母编号).
a.盛装 0.2000mol/LNaOH溶液
b.用0.2000mol/L NaOH溶液润洗
c.读数、记录
d.查漏、清洗
e.排尽滴定尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是 .
实验2:连接装置A﹣D﹣B,检查气密性.按图示重新加入试剂;通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物。停止加热,冷却.停止通入N2,观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32﹣无SO42﹣。进一步研究发现,气体产物中无氮氧化物.
(4)检查装置D内溶液中有SO32﹣ 、无SO42﹣的实验操作和现象是 .
(5)装置B内溶液吸收的气体是 .
(6)(NH4)2SO4在400℃分解的化学方程式是 .
B.[实验化学]卷心菜中含有丰富的维生素C,维生素C在酸性溶液中能被碘氧化。某实验小组通过如下实验对卷心菜中维生素C的含量进行测定。
第一步:配制维生素C标准溶液。将5片100 mg的维生素C药片碾碎、溶解,配成250 mL标准溶液。
第二步:制取卷心菜汁。取50 g新鲜的卷心菜,捣烂,加水充分搅拌,用下图所示装置抽滤制得卷心菜汁50 mL。
第三步:标准溶液中维生素C含量的测定。移取20.00 mL维生素C标准溶液于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V1。
第四步:卷心菜汁中维生素C含量的测定。移取20 mL卷心菜汁于锥形瓶中,加入1 mL 0.1 mol·L-1盐酸酸化,加入2滴淀粉试液作指示剂,用0.010 mol·L-1碘水滴定到终点,记录消耗碘水的体积。重复上述操作两次,消耗碘水的平均体积为V2。
(1)与过滤相比,抽滤的优点是 。抽滤所用的滤纸应略 (填“大于”或“小于”)布氏漏斗内径,将全部小孔盖住。
(2)移取20.00 mL待测液选用的仪器是 ,滴定终点溶液的颜色呈 色。
(3)上述滴定过程滴定速度要快,否则将会使测得的维生素C的含量偏低,其可能的原因是 。
(4)1kg卷心菜中所含维生素C相当于 片上述维生素药片。(用含V1、V2的代数式表示)
碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是: 在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目
该反应中还原产物与氧化产物的物质的量比是__________,0.2mol KIO3参加反应时转移电子__________mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是________
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是 ,所用主要玻璃仪器是
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1 mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4 mL,配制中需要用到的主要玻璃仪器是(填序号) .
A 100mL量筒 B 托盘天平
C 玻璃棒 D 100mL容量瓶
E 50mL 量筒 F 胶头滴管 G 烧杯 H 500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是___________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。

(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
(14分)如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:

(1)钠与水反应的化学方程式为 。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是 。
②能证明钠的熔点低的现象是 。
③能证明有氢氧化钠生成的现象是 。
④能证明有气体产生的现象是A端液面 (填“A.上升”、“B.下降”或“C.不变”,下同),B端液面 。
⑤钠燃烧产物与H2O反应的化学方程式 。
实验室有一包固体粉末样品可能是MgCO3、Fe2O3和FeO的混合物。
Ⅰ.甲学生设计实验方案,以确定样品中是否含有FeO。除样品外,实验室只提供以下试剂:
KMnO4溶液、盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述甲学生的实验操作步骤、现象及结论:____________________。
Ⅱ.经甲学生实验确定该样品中不存在FeO,乙学生想在甲学生的实验基础上进一步来测定混合物中Fe2O3的含量:乙学生准备用如图所示各仪器按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数.
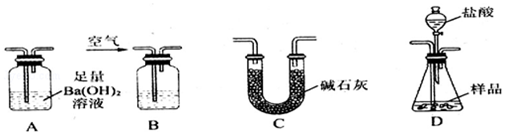
请回答下列问题:
(1)盛装盐酸的仪器的名称是 ,装置的连接顺序是: → → → (填图中字母序号,各仪器只能选用一次).
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是:________________ .
(3)为提高测定的准确度,在B中最应加入的物质是: (填编号).
a.饱和NaHCO3溶液 b.蒸馏水 c.浓硫酸 d.NaOH溶液
(4)在进行乙学生的实验方案评价时,有学生认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将 (填“偏大”、“偏小”或“不变”).
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
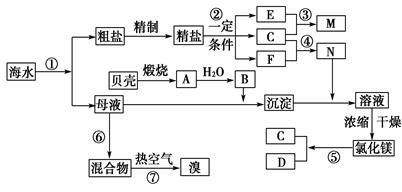
Ⅰ.(1)写出N的化学式_________________________;
(2)写出反应②的化学方程式_________________________。
Ⅱ.粗盐中含有Ca2+、Mg2+、
SO42-等杂质,精制时所用的
试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为____________。
A.②③④① B.③④②① C.④③②① D.③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是____________。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是____________。
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2 乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?______(填“甲”或“乙),理由是____________________________ ___。
ClO2是一种国际上公认的安全无毒的绿色水处理剂。回答下列问题:
(1)工业废水的处理:
某实验兴趣小组通过右图装置制备ClO2,并用它来处理Wg某T业废水(含Mn2+、CN-等)。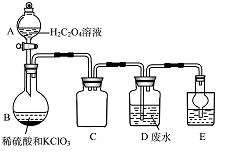
已知:i.ClO2为黄绿色气体,极易溶于水,沸点11℃;
ii.ClO2易爆炸,若用“惰性气体”等稀释时,爆炸性则大大降低;
iii.某T业废水处理过程中Mn2+转化为MnO2、CN-转化为对大气无污染的气体;
iv.装置B中发生的反应为:H2C2O4+H2SO4+2KClO3=K2SO4+2CO2++2C1O2+H2O.
①A装置的名称是 ,C装置的作用为 。
②用H2C2O4溶液、稀硫酸和KC1O3制备ClO2的最大优点是 。
③写出装置D中除去Mn2+的离子方程式 。
④E装置中盛放的试剂可选用 (填标号)。
a.CCl4 b.H2O c.稀盐酸 d.NaOH溶液
(2)废水中CN-含量的测定:
另取工业废水W g于锥形瓶中,加入10 mL0.10 mol/L的硫酸溶液,用0.020 0 mol/L的KMnO4标准溶液进行滴定,当达到终点时共消耗KMnO4标准溶液25. 00 mL。在此过程中:
①使用棕色滴定管的原因是 ,滴定终点的判断依据是________________。
②W g 工业废水中CN-的含量为 mol。
③若滴定管在盛放标准溶液前未用标准液润洗,则测定结果将 (填“偏高”、“偏低” 或“无影响”)。
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:ICl(l)+Cl2(g)=ICl3(l)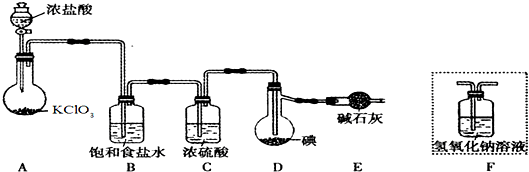
(1)装置A中发生反应的化学方程式是________________________________;
(2)装置B的作用是___________________,不能用装置F代替装置E,理由_______________________;
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是___________(填标号);
| A.过滤 | B.蒸发结晶 | C.蒸馏 | D.分液 |
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度.进行如下两个实验,实验过程中有关反应为:
①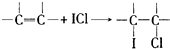
②ICl+KI═I2+KCl
③I2+2Na2S2O3═2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol•L-1的Na2S2O3标准溶液滴定.经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL.
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL.
①滴定过程中可用___________作指示剂.
②滴定过程中需要不断振荡,否则会导致V1_________(填“偏大”或“偏小).
③5.00g该油脂样品所消耗的ICl的物质的量为___________mol,由此数据经换算即可求得该油脂的不饱和度。
某固体粉末甲中可能含有K2CO3、KNO3、NaNO2、K2SO3、FeO、Fe2O3中的若干种,某同学为确定该固体粉末的成分,取甲进行连续实验,实验过程及现象如下:

该同学得出的结论正确的是( )
| A.根据现象1可推出该固体粉末中含有钠元素,但不含钾元素 |
| B.根据现象2可推出该固体粉末中一定含有NaNO2 |
| C.根据现象3可推出该固体粉末中一定含有Na2SO4 |
| D.根据现象4和现象5可推出该固体粉末中一定含有FeO和Fe2O3 |
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O)俗称吊白块,不稳定,120℃时会分解。在印染、医药以及原子能工业中有广泛应用。以Na2SO3、SO2、HCHO和锌粉为原料制备次硫酸氢钠甲醛的实验步骤如下:

步骤1:在三颈烧瓶中加入一定量Na2SO3和水,搅拌溶解,缓慢通入SO2,至溶液pH 约为4,制得NaHSO3溶液。
步骤2:将装置A 中导气管换成橡皮塞。向烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤;
步骤3:将滤液真空蒸发浓缩,冷却结晶。
(1)装置B 的烧杯中应加入的溶液是 ;冷凝管中冷却水从 (填“a”或“b”)口进水。
(2)A中多孔球泡的作用是 。
(3)冷凝管中回流的主要物质除H2O 外还有 (填化学式)。
(4)写出步骤2中发生反应的化学方程式 。
(5)步骤3中在真空容器中蒸发浓缩的原因是 。
(6)为了测定产品的纯度,准确称取2.0g样品,完全溶于水配成100mL溶液,取20.00mL所配溶液,加入过量碘完全反应后(已知I2不能氧化甲醛,杂质不反应),加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.466g,则所制得的产品的纯度为 。
乙二酸俗称草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4•xH2O)中x的值。通过查阅资料该小组同学知道,草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
该组同学设计了如下滴定方法测定x的值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到反应终点时消耗了10.00mL;
请回答:
(1)滴定时,将KMnO4标准溶液装在图中的 (选填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是 。
(3)通过上述数据,可计算出x= 。
(4)若滴定终点时俯视滴定管刻度,则由此测得的x值会 (选填“偏大”、“偏小”或“不变”,下同)。若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。